No-связь
Cтраница 1
Длина NO-связи в комплексе ( 1 37 А) близка к длине этой связи в ( CH3) 3NO [ 348J, а также к сумме ковалентных радиусов атомов О и N. Этот факт показывает, что дополнительное я-взаимодействие, которое имеет место в незакомплексованной молекуле C5H8NO, нарушается при образовании комплекса. [1]
В нитрогруппе NO2 длина NO-связи равна 0 122 нм, в то время как в случае простой связи она должна была бы быть равной 0 136 нм, при двойной - 0 115 нм. Эти данные подтверждают представление о том, что в нитрогруппе атомы азота и кислорода связаны трехэлектронной связью. [2]
Рассмотрим сначала дипольный момент окиси триметиламина, почти полностью обусловленный наличием NO-связи. [3]
Таким образом, сложность изменений частот колебаний нитрогруппы в зависимости от электронного строения нитросоединений ( особенно в случае неэквивалентных NO-связей) требует достаточной осторожности в интерпретации экспериментальных данных, особенно при чисто эмпирическом подходе к трактовке спектров. [4]
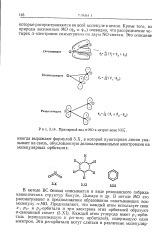 |
Примерный видя - МО в нитрит-ионе М02. [5] |
Кроме того, из природы заселенных МО ( tyb и ф) очевидно, что распределение четырех я-электронов симметрично по двум NO-связям. [6]
Разность между этой величиной и опытной [ 5 02 Д ( 16 57 - К) 30 Кл - м) ] вызывается обратной поляризацией NO-связи, индуцированной ее собственным диполь-ным моментом. Однако эта разница дает заниженное значение обратной поляризации, так как незначительные наведенные моменты в метальных группах также входят в наблюдаемый дипольный момент. Данное явление является общим для моментов диполярных связей: наблюдаемые моменты меньше вычисленных для перемещения электрона между неполяризуемыми атомами. Более высокие значения моментов других соединений серии 1 должны быть приписаны частично моменту, вызванному электроотрицательным атомом галогена, и частично большей длине связей в соединениях фосфора, серы и алюминия. Если пренебречь м: алыми эффектами, то дипольный момент приведенного в таблице соединения бериллия можно считать векторной суммой моментов двух диполярных связей, которые, будучи направлены к вершинам тетраэдра, имели бы величины 5 81 Д ( 19 17 - 10 - 30 Кл - м); эта величина включает возмущение, вносимое одним атомом хлора и одной этильной группой. [7]
Из этого следует, что две нитрогруппы аниЪна тринитрометана являются солевыми, а третья - несолевая. Сущность различий солевой и несолевой нитрогрупп конкретно заключается в соотношении силовых постоянных GN - и NO-связей: если / ( NO / CcN - несолевая группа; если Kw KNO - солевая нитро-группа. Конечно, это весьма условное, упрощенное рассмотрение, но такой подход оказывается достаточно удобным для понимания колебательных спектров. [8]
В самой работе [45] отличие величин а для внутренней области слоя от величины а, соответствующей гидрофобному окружению ( 13 8 гс), объясняется существованием в слое электростатического поля от зарядов, локализованных на поверхности слоя. Как отмечено в работе [47], если бы это было действительно так, то величина а для радикального фрагмента, локализованного в глубине слоя на некотором расстоянии от его поверхности, зависела бы от степени ориентации этого радикального фрагмента ( так как при этом изменялась бы средняя величина проекции напряженности электростатического поля на направление NO-связи. [9]
Если один из атомов углерода, образующих формально простую связь, имеет симметрию второго порядка, то конформационная изомерия исчезает, но барьер вращения остается. Симметрию второго порядка имеет фенильная группа фенола, поскольку ненасыщенность двойных связей бензольного кольца симметрично распространяется на все кольцо ( см. разд. Нитрогруппа также имеет симметрию второго порядка, поскольку ненасыщенность двойной связи симметрично распределяется между двумя NO-связями. [10]
 |
Силовые постоянные метилнитрамина. [11] |
Сопоставление силовых постоянных ЫМС - группы метилнитрамина с силовыми постоянными CNO2 - rpynnbi нитрометана позволило сделать выводы о различиях электронного строения этих групп. CN - ординарная; в молекуле метилнитрамина реализуется значительное выравнивание порядков NO - и NN-связей. Квантово-химиче-ские расчеты электронных параметров нитрометана и метилнитрамина [74] согласуются с таким представлением. Уменьшение порядка NO-связи сопровождается увеличением отрицательного заряда на атомах кислорода нитрогруппы. [12]
Страницы: 1