А-амилаза
Cтраница 2
Эту связь избирательно расщепляет а-амилаза. [16]
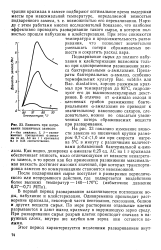 |
Вязкость при нагревании пшеничных замесов. [17] |
Как видно, дозировка а-амилазы 0 25 ед. АС на 1 г крахмала обеспечивает вязкость, мало отличающуюся от вязкости ненагретого замеса, в то время как без применения разжижения максимальная вязкость достигает высоких значений, при которых транспортировка замесов по коммуникациям становится невозможной. [18]
Наиболее вероятный механизм действия а-амилазы - двойное замещение, сущность которого заключается в разрыве глюкозидной связи в результате про-тоннрования кислородного мостика NH-группой имидазола. В образующемся при этом фермент-субстратном комплексе субстрат связан ковалентной связью с карбоксильной группой фермента. На этой стадии реакции происходит иервое Валь-деновское обращение. [19]
Гидролиз о-нитрофенил-а-мальтозида, катализируемый а-амилазой, изучали с помощью метода остановленной струи. В табл. 6 приведена зависимость концентрации образующегося в реакции о-нитрофенола от времени в начальный период реакции. [20]
А и Б - действие а-амилазы на линейную и разветвленную цепи полиоз; В и Г - действие р-амилазы на линейную и разветвленную цепи полиоз. [21]
Появление в крови большого количества а-амилазы или липазы свидетельствует о наличии острого панкреатита, а лактатдегидрогеназы - инфаркта миокарда. Увеличение в сыворотке крови активности кислой фосфатазы однозначно указывает на наличие рака предстательной железы, а повышенное содержание церулоплазмина связано с наследственной патологией - гепато-лентикулярной дегенерацией. [22]
Обнаружены различия в аминокислотном составе а-амилазы термофильных и мезофиль-ных форм микробов. Содержание глютаминовоц и аспарагиновой аминокислот в а-амилазах термофильных штаммов больше, чем в а-амилазах мезофилов. Как известно, эти аминокислоты могут легко связываться с ионами кальция. [23]
Из амилолитических ферментов, например, а-амилаза активируется ионами кальция, который способствует сохранению нужной конформации и повышению стабильности третичной структуры макромолекул фермента к денатурации и действию пептидгидролаз. На плесневые а-амилазы стабилизирующее действие оказывают ионы алюминия. Все а-амилазы инактивируются ионами металлов ртути, меди, серебра и ионами галоидов - хлора, брома, фтора и йода. [24]
К ним относятся слюнная и панкреатическая а-амилаза, гидролизующая а - ( 1 - 4) - гликозидные связи крахмала и гликогена; специфические дисахаро-зидазы - мальтаза, изомальтаза, сахараза ( инвертаза), лактаза, расщепляющие соответствующие дисахариды до моносахаридов. Амилаза не расщепляет ( 1 - 6) - а-гликозидные связи, поэтому в амилопектине значительная часть молекулы остается нерасщепленной. Такой частично переваренный амилопек-тин называется декстрином, в тонком кишечнике он расщепляется ферментом амило-а - ( 1 - 6) - глюкозидазой. В дисахариде изо-мальтозе глюкозные остатки также соединены а-1 6-гликозидной связью. [25]
Это объясняется тем, что действие а-амилазы прекращается, когда она встречает препятствия в виде 1 - 6 а-связей. Поэтому при отсутствии декстриназы остается большее количество неосахаренных декстринов. [26]
Так, при 72-часовом брожении расход а-амилазы должен составлять 1 5 ед. При 48-часовом брожении расход а-амилазы остается неизменным, а глюкоамилазы увеличивается до 15 ед. При этом показатели выбраживания получаются не хуже, чем при 72-часовом брожении. [27]
Данные по гидролизу амилозы, катализируемому а-амилазой, были объяснены на основе теории Хироми [61, 62] о влиянии диэлектрической проницаемости среды на скорость реакций при разумном выборе значений рассматриваемых параметров. [28]
С другой стороны, слишком высокая односторонняя активность а-амилазы может привести к избыточному накоплению в тесте декстринов, что ухудшит качество хлеба. [29]
Микроорганизм Bacillus macerans содержит фермент, обладающий одновременно действием а-амилазы и необычным свойством синтезировать циклические декстрины в результате образования а-гликозидной связи между восстанавливающим концом и гидроксилом положения 4 невосстанавливающего конца. При этом образуются три циклических декстрина a. Так как циклические декстрины не обладают невосстанавливающими концами, они не подвергаются атаке ( 3-амилазой. Однако они гидролизуются ( 3-амилазой в присутствии фермента из Bacillus macerans, откуда следует, что этот фермент обладает обратимым действием. [30]
Страницы: 1 2 3 4