Скорость - нитрование
Cтраница 3
Скорость нитрования первого порядка зависит от двух факторов: стационарной концентрации нитроний-иона и константы скорости взаимодействия нитроний-иона с нитруемым соединением. [31]
Скорость нитрования ароматических углеводородов в парах значительно меньше, чем в жидкой фазе; в случае предельных углеводородов скорость нитрования в парах и жидкой фазе почти одинакова. [32]
На скорость нитрования оказывают влияние не только электронные, но и пространственные факторы, в частности отклонения от копланарности. Иллюстрацией может служить поведение 2 6-ди-нитрохлорбензола, в котором, вследствие пространственных затруднений, нитрогруппы выводятся из плоскости бензольного кольца. Это ослабляет действие нитрогрупп на ядро, в результате чего 2 6-динитрохлорбензол нитруется значительно быстрее, чем 2 4-ди-нитрохлорбензол и л-динитробензол. [33]
Почему скорость нитрования нитробензола нитрующей смесью возрастает в 1000 раз, если вместо 80 % - ной серной кислоты взять 90 % - ную. [34]
Снижение скорости нитрования при уменьшении концентрации серной кислоты ниже 90 % объясняется в настоящее время сопутствующим уменьшением концентрации нитроний-иона. Причина же падения скорости нитрования при увеличении концентрации серной Кислоты сверх 90 % до сих пор остается неясной. Выдвинутое Беннетом и другими [63] объяснение, основанное на принятии Тримолекулярной реакции в качестве определяющей стадии процесса нитрования, оказалось, как установил Меландер р61, несостоятельным. Выше было показано, что наличие три-молекулярной реакции при нитровании ароматических соединений отрицает и Ингольд. В литературе, однако, имеется и другое предположение о причине замедления скорости нитрования с ростом кбнцентрации серной кислоты свыше 90 %, которое связывает этот факт с основным характером нитруемого соединения. [35]
Константы скорости нитрования справа от оптимума кислотности вызвано снижением коэффициента активности нитро-соединения. [36]
Уменьшение скорости нитрования при концентрациях серной кислоты выше 90 % тщательно исследовалось. [37]
Максимум скорости нитрования при определенной концентрации серной кислоты и небольшом количестве HNO3, как это имеет место в гомогенных условиях, в гетерогенных условиях отеугстнует ( см. данные табл. 31 и фиг. [38]
Снижение скорости нитрования при уменьшении концентрации серной кислоты ниже 90 % объясняется в настоящее время сопутствующим уменьшением концентрации нитроний-иона. Причина же падения скорости нитрования при увеличении концентрации серной Кислоты сверх 90 % до сих пор остается неясной. Выдвинутое Бенадтом и другими [63] объяснение, основанное на принятии Тримолекулярной реакдии в качестве определяющей стадии процесса нитрования, оказалось, как установил Меландер [ ( J6 ], несостоятельным. Выше было показано, что наличие три-молекулярной реакции при нитровании ароматических соединений отрицает и Ингольд, В литературе, однако, имеется и Другое предположение о причине замедления скорости нитрования с ростом кбнцентрации серной кислоты свыше 90 %, которое связывает этот факт с основным характером нитруемого соединения. [39]
Увеличение скорости нитрования ароматических соединений при наличии в них групп, участвующих в общем сопряжении и подающих электроны в зону реакции, понятно, так как подача электронов стабилизирует свободные радикалы ( стр. Более легкое нитрование пиридина окислами - азота по сравнению с азотной кислотой можно объяснить тем, что в последнем случае воздействию NOJ подвергается не свободный пиридин, а соль пиридина, в которой электронная плотность в ядре вследствие отрицательного индуктивного влияния положительно заряженного азота меньше, чем в свободном пиридине. [40]
За скоростью нитрования мы следим по расходованию азотной кислоты. Для этого через определенные промежутки отбирали пробы и титровали раствором Ва ( ОН) 2 в присутствии фенол-фталеина. [41]
Таким образом скорость нитрования определяется частотой столкновений между молекулой динитротолуола, ионом N0 и молекулой акцептора протона. [42]
В результате скорость нитрования особенно мала в орто - и пара-положениях; медленно, но значительно быстрее, нитрование протекает по месту наименее положительно заряженного углерода-в мета-положении. [43]
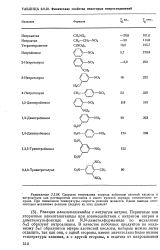 |
Физические свойства некоторых нитросоединений. [44] |
Упражнение 2.2.58. Скорость нитрования толуола избытком азотной кислоты в нитрометане как растворителе постоянна и имеет нулевой порядок относительно толуола. При повышении температуры скорость реакции меняется. Какие выводы относительно механизма реакции следуют из этих данных. [45]
Страницы: 1 2 3 4