Избыток - связывающий электрон
Cтраница 2
В молекуле Сг разрыхляющих электронов два, а связывающих - шесть, избыток связывающих электронов равен четырем, поэтому можно считать, что связь в данной молекуле двойная. [16]
В молекуле С: разрыхляющих электронов два, а связывающих - шесть, избыток связывающих электронов равен четырем, поэтому можно считать, что связь в данной молекуле двойная. [17]
Формально кратность связи здесь может рассматриваться как 2 / 2, так как избыток связывающих электронов равен пяти. [18]
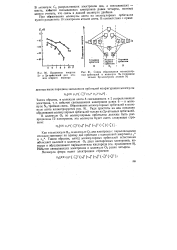 |
Изменение энергии 2s - и 2 / 7-орбиталей для атомов второго периода.| Схема образования молекулярных орбиталей в молекуле Na ( показаны только 2р - электроны атомов N. [19] |
Таким образом, в молекуле азота 8 связывающих и 2 разрыхляющих электрона, т.е. избыток связывающих электронов равен 6 - в молекуле N2 тройная связь. Ради простоты на нем показано образование молекулярных орбиталей только из 2р - атомных орбиталей. [20]
Два избыточных по сравнению с молекулой F2 электрона могут быть размещены лишь на Заи-орбитали, что уменьшает избыток связывающих электронов по сравнению с разрыхляющими до нуля. Система Ne2 в своем основном состоянии нестабильна. [21]
 |
Взаимосвязь между энергиями атомных орбиталей и энергиями молекулярных орбиталей для молекул от Li2 до N2. [22] |
Два избыточных по сравнению с молекулой р2 электрона могут быть размещены лишь на Зсты-орбитали, что уменьшает избыток связывающих электронов по сравнению с разрыхляющими до нуля. Система Ne2 в своем основном состоянии нестабильна. [23]
 |
Контурная карта разностной. [24] |
Молекула Ве2 с электронной конфигурацией основного состояния КК ( a 2s) 2 ( a 2s) 2 не имеет избытка связывающих электронов. Эта молекула экспериментально не обнаружена. Возбужденные состояния этой молекулы могут наблюдаться спектроскопически. [25]
Молекула Ве2, имеющая электронную конфигурацию основного состояния / C / C ( o2s) 2 ( a 2s) 2, не имеет избытка связывающих электронов. Эта молекула экспериментально не обнаружена. Возбужденные состояния этой молекулы могут наблюдаться спектроскопически. [26]
Из таблицы 36 видно, что в ряду однотипных двухъядерных гетеронуклеарных молекул, так же как и в ряду двухъядерных гомонуклеарных молекул ( табл. 35), энергия связи и длина связи зависят от избытка связывающих электронов в молекуле. [27]
Таким образом, на МО внешнего энергетического уровня разместилось 10 электронов, из которых 8 находятся на связывающих ор-биталях, а два - на разрыхляющей орбитали. Избыток связывающих электронов равен шести, порядок связи - трем. [28]
У N2 избыток связывающих электронов равен 6, 3 валентные химические связи. У О2 избыток связывающих электронов 4, ковалентность 2, 2 неспаренных электрона на разрыхляющих л - и л - орбиталях, кислород парамагнитен. Магнитные свойства ( см. 9.3) кислорода, следовательно, получают достоверное объяснение в методе МО. [29]
В молекуле СО избыток связывающих электронов равен 6, поэтому связь в данной молекуле можно считать тройной, таким образом, другим путем мы пришли к выводу, который был сделан ранее. [30]
Страницы: 1 2 3 4