Изгибание - связь
Cтраница 1
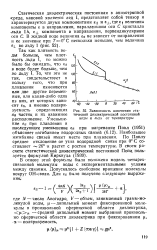 |
Зависимость изменения статической диэлектрической постоянной воды и льда от температуры. [1] |
Наибольшее изгибание связей имеет место при плавлении. По Поплу среднее отклонение от угла водородной связи при 0 С со-ставляет - 26 и растет с ростом температуры. [2]
Интересно, что рассчитанная степень изгибания связей для циклобутана также составляет примерно одну треть от изгибания циклопропановых связей. [3]
Укорочение длины С-С - связи в циклопропане является следствием изгибания связи, при котором электронная плотность частично сдвигается за ось С-С, что заметно уменьшает ковалентный радиус атомов углерода. Длины С-С - свя-зей в циклобутане, циклопентане и циклогексане значительно более близки к длинам связей в ациклических углеводородах. Длины С-С - связей в полициклоалканах, не обладающих необычной структурой, очень близки к длинам связей в моноциклоалканах. Большие отклонения наблюдаются только в том случае, если в жестких системах имеет место сочленение с малыми циклами. [4]
К нормальным колебаниям молекулы реагента относятся и два других, которые можно представить как изгибание связи, примыкающей к водородному атому. Имеется некоторая вероятность того, что частота этого колебания может быть больше в переходном состоянии, чем в реагенте ( [21], стр. [5]
Интересно, что рассчитанная степень изгибания связей для циклобутана также составляет примерно одну треть от изгибания циклопропановых связей. [6]
Отклонение молекул от идеального копла-нарного состояния происходит главным образом вследствие закручивания и в меньшей степени изгибания связей. [7]
Наблюдение характеристических частот связи приводит к представлению о колебаниях растяжения связей и о колебаниях в изгибании связей. Колебание растяжения связей рассматривается как периодическое изменение длины связи, и колебание изгибания рассматривается как периодическое изменение угла связи. Эта классификация имеет большое значение в тех случаях, когда молекула содержит только несколько атомов и не применима к сложным многоатомным молекулам. [8]
Как показывают спектроскопические исследования, степень легкости искажений в молекуле возрастает в следующем порядка: растяжение связи изгибание связи ( деформаиия) закручивание связи. Эффекты, вызываемые перегруженностью, в значительной степени ( хотя и не полностью) могут быть описаны как искажения двух последних типов. [9]
Следовательно, чтобы перенос электронов был возможен, у реагирующих веществ должно произойти выравнивание энергий за счет сжатия, вытягивания или изгибания связей. Расчеты показывают, что выравниванию энергии при длине связей 2 09 А соответствует энтальпия активации 5 6ккал / моль. Наблюдаемая величина составляет 10 5 ккал / моль, следовательно, рассмотренное ограничение не является единственным. Кроме вкладов от выравнивания энергии связи и мультиплетности спина, энергия активации включает также вклады, возникающие в результате столкновения заряженных частиц и неизбежной перегруппировки соль-ватных оболочек. В оценке этих вкладов наблюдается расхождение при различных теоретических подходах. [10]
Благодаря поляризации электронных облаков в молекулах, последние приобретают индуцированный магнитный момент, направленный противоположно внешнему полю. Вследствие этого, энергия водородных связей изменяется, происходит изгибание связей и разрыв, что влечет за собой изменение взаимного расположения молекул, а следовательно, и структуры воды. [11]
Благодаря поляризации электронных облаков в молекулах, последние приобретают индуцированный магнитный момент, направленный противоположно внешнему полю. Вследствие этого, энергия водородных связей изменяется, происходит изгибание связей и разрыв, что влечет за собой изменение взаимного расположения молекул, а следовательно, и структуры воды. [12]
Поскольку эксперимент говорит об обратном, то для трех - и четырехчленных циклов приходится допустить существование аномальных значений валентных углов. Чтобы привести это допущение в согласие с тетраэдрической моделью, вводится дополнительный постулат о возможности искажения нормальных значений валентных углов в таких системах путем напряжения или изгибания связей в исходной тетраэдрической модели. [13]
В связи с этими выводами следует заметить, что годом раньше Бартел [67] пришел к выводу о влиянии на длины связей внутримолекулярных вандерваальсовых сил, приводящем, например, к удлинению связи С - С в алмазе на 0 01 А по сравнению со связями С - С в нормальных парафинах. Существование невалентных сил отталкивания заставляет с осторожностью относиться к вычислениям гибридизации из валентных углов, так как эти силы не только могут привести к искажению валентных углов ( до 3), но и к изгибанию связей ( bending of the bonds), которое, впрочем, в нормальных углеводородах почти не сказывается на длинах связей С - С. [14]
 |
Параметры метода Попла для сопряженных углеводородов. [15] |
Страницы: 1 2