Измерение - потенциал - электрод
Cтраница 3
Это показывает, что измерение потенциала электрода при помощи капилляра, впаянного с обратной стороны электрода, при правильном подборе диаметра капилляра практически устраняет ошибки, обусловленные экранировкой и омическим сопротивлением электролита. Эти ошибки особенно велики и поэтому должны учитываться при измерении поляризации в разбавленных растворах и при высоких плотностях тока. Это весьма важно при измерении потенциала на больших электродах, когда в электролите велико падение напряжения вследствие высокой объемной плотности тока в растворе. [31]
Существует два основных метода измерения потенциала электрода под током: метод Нернста - Глезера и метод измерения с помощью капилляра Луггина - Габера. Метод Нернста - Глезера основан на том, что электрод сравнения, являющийся одновременно и поляризующимся электродом, имеет поверхность, во много раз большую, чем рабочий электрод. Поэтому при пропускании малых токов ( например, в полярографии около 10 - 6 А) плотность тока на электроде сравнения настолько мала, что его потенциал остается практически равновесным. [32]
Другой способ состоит в измерении потенциала электрода, реагирующего на изменение концентрации определяемых ионов. В конечной точке обычно наблюдается резкое изменение потенциала этого индикаторного электрода, указывающее на необходимость прекращения электролиза. Примером такого потенциометрического способа установления конца электролиза может служить кулонометрическое определение ионов двухвалентного железа посредством его окисления в трехвалентное. [33]
Потенциометрический метод основан на измерении потенциала электрода, погруженного в анализируемый раствор. В сухой стакан наливают 25 - 40 мл растворителя и нейтрализуют примеси в растворителе по соответственно выбранному индикатору ( или проводят холостой опыт), затем помещают навеску анализируемого вещества или соответствующую аликвотную часть раствора и опускают электроды ( см. рис. 15); электроды предварительно обмывают дистиллированной водой, ополаскивают спиртом и осушают фильтровальной бумагой. Титрованный раствор из бюретки добавляют по 0 1 мл, а вблизи точки эквивалентности по 0 02 - 0 05 мл; перемешивание осуществляют магнитной мешалкой; после каждого добавления титранта дают установиться потенциалу и снимают показания потенциометра. Титрование продолжают до установления постоянного потенциала. [34]
Другой способ состоит в измерении потенциала электрода, реагирующего на изменение концентрации определяемых ионов. В конечной точке обычно наблюдается резкое изменение потенциала этого индикаторного электрода, указывающее на необходимость прекращения электролиза. Примером такого потенциометрического способа установления конца электролиза может служить кулонометрическое определение ионов двухвалентного железа посредством его окисления в трехвалентное. [35]
Потенциометрические методы основаны на измерении потенциалов электродов, обратимых по отношению к каким-либо ионам. Потенциомет-рия широко используется для определения концентрации веществ в растворах, в автоматических непрерывных методах контроля различных технологических процессов. Методы потенциометрии делятся на прямую потенциометрию, ионометрию, потенциометрическое титрование и оке-ре дметрию. [36]
Выше уже говорилось о невозможности измерения потенциала единичного электрода, и поэтому всегда измеряют разность потенциалов исследуемого электрода и какого-либо другого электрода с известным ( по водородной шкале) значением потенциала, вычисляя затем неизвестное значение потенциала. Вспомогательные электроды с известным, хорошо воспроизводимым скачком потенциала, которые используются при проведении измерений потенциалов, называются электродами сравнения. [37]
 |
Каломельный электрод. [38] |
Потенциометрический метод анализа основан на измерении потенциала электрода, погруженного в раствор. Значение потенциала зависит от концентрации соответствующих ионов в растворе. Например, потенциал серебряного электрода, погруженного в раствор соли серебра, изменяется с изменением концентрации Ag - HOHOB в растворе. Поэтому, измерив потенциал электрода, погруженного в раствор данной соли неизвестной концентрации, можно определить содержание соответствующих иовов в растворе. [39]
 |
Каломельный электрод. [40] |
Потенциометрический метод титрования основан на измерении потенциала электрода, погруженного в раствор. Величина потенциала зависит от концентрации соответствующих ионов в растворе. Например, величина потенциала серебряного электрода, погруженного в раствор соли серебра, изменяется с изменением концентрации Ag в растворе. Поэтому, измерив потенциал электрода, погруженного в раствор данной соли неизвестной концентрации, можно определить содержание соответствующих ионов в растворе. [41]
 |
Каломельный остается неизменной при изменении концентра-электрод. ции определяемых ионов. Обычно в качестве. [42] |
Потенциометрический метод титрования основан на измерении потенциала электрода, погруженного в раствор. Величина потенциала зависит от концентрации соответствующих ионов в растворе. [43]
Потенциометрический метод анализа основан на измерении потенциала электрода, погруженного в раствор. Потенциал такого электрода зависит от концентрации соответствующих ионов в растворе и от тех изменений электрохимических свойств раствора или самого определяемого вещества, которые протекают в процессе химических реакций. Измеряя величину потенциала электрода, можно проследить за ходом химических реакций и осуществить контроль отдельных аналитических операций. [44]
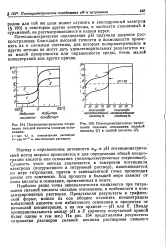 |
Потенциометрическое титро - [ IMAGE ] Потенциометрическое титрование сильной кислоты сильным осно - вание сильным основанием Сильной ванием. кислоты ( / и слабой кислоты ( 2. [45] |
Страницы: 1 2 3 4