Измерение - окислительный потенциал
Cтраница 1
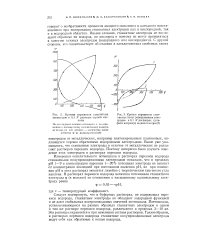 |
Кривые заряжения станнатных электродов в 0 1 N растворе серной кислоты.| Кривые заряжения станнатных полупроводниковых электродов в 0 1 7V растворах сульфата натрия ( / и едкого натра ( 2. [1] |
Измерения окислительного потенциала в растворах перекиси водорода станнатными полупроводниковыми электродами показали, что в пределах рН 1 - 9 и концентрации перекиси 1 - 20 % потенциал электрода не зависит от концентрации последней при постоянном значении рН, но при изменении рН в этих растворах меняется линейно с теоретическим тангенсом угла наклона. [2]
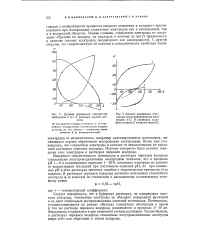 |
Кривые заряжения станнатных электродов в 0 1 N растворе серной кислоты.| Кривые заряжения станнатных полупроводниковых электродов в 0 1 N растворах сульфата натрия ( / и едкого натра ( 2. [3] |
Измерения окислительного потенциала в растворах перекиси водорода станнатными полупроводниковыми электродами показали, что в пределах рН 1 - 9 и концентрации перекиси 1 - - 20 % потенциал электрода не зависит от концентрации последней при постоянном значении рН, но при изменении рН в этих растворах меняется линейно с теоретическим тангенсом угла наклона. [4]
Для измерения окислительного потенциала необходимо, чтобы центральные ионы были ионами переменной валентности. Окислительный потенциал в растворе, содержащем различные Окислительно-восстановительные системы может быть выражен через активности окисленной и восстановленной форм любой из этих систем. [5]
Для измерения окислительного потенциала необходимо составлять цепь из индикаторного платинового электрода титруемого раствора и каломелевого электрода сравнения. Величину EQ можно определить для полувосстановленных растворов, так как в таких растворах концентрация окислителя равна концентрации восстановителя [ Ок. Нернста обращается в единицу, а его логарифм равен нулю. Величина этого нулевого потенциала соответствует точке перегиба на кривой, выражающей переход окисленной формы в восстановленную. [6]
Для измерения окислительного потенциала составляется гальванический элемент, включающий окислительно-восстановительный полуэлемент. В качестве второго ( стандартного) полуэлемента обычно применяется не нормальный водородный электрод, а какой-либо вспомогательный электрод. Широкое использование насыщенного каломельного электрода в качестве вспомогательного объясняется малой величиной диффузионного потенциала, возникающего на границе со - лржкосноления насыщенного раствора хлористого кал. В концентрированных сильно кислых и сильно щелочных растворах диффузионный потенциал возрастает, что вносит, неопределенность в величину окислительного потенциала. [7]
Однако измерения окислительных потенциалов в неводных средах не позволяют судить о поведении этих красителей в водной среде ( см., например [8]), поэтому такие измерения не имеют существенного практического значения. [8]
Для измерения окислительного потенциала необходимо составлять цепь из индикаторного платинового электрода титруемого раствора и каломельного электрода сравнения. [9]
 |
Определение среднеточечного окисли-тельного потенциала полиметиленферроценилена. [10] |
Для измерения окислительного потенциала жидкого редоксита медиатор не нужен. Измерения с медиатором, когда индифферентный электрод помещен так же в водный раствор, дают совпадающие значения окислительных потенциалов. [11]
Значение измерений окислительного потенциала в аналитической химии общеизвестно. [12]
Метод измерений окислительных потенциалов является перспективным для изучения комплексообразования ионов металлов переменной валентности. [13]
При измерениях окислительного потенциала колориметрическим методом для получения термодинамического значения потенциала необходимо, чтобы система приходила в равновесие с индикатором. Для этого при измерениях окислительного потенциала в системах, в которых процессы окисления - восстановления осуществляются с участием водорода и, в особенности, кислорода, так же как и при электрометрическом измерении, требуется введение катализаторов, ускоряющих окислительно-восстановительную реакцию. Кроме того, необходимо, чтобы при измерениях потенциала систем, в которых процесс восстановления осуществляется водородом, окисленная форма индикатора достаточно быстро восстанавливалась водородом. [14]
Служат для измерения окислительного потенциала. Изготавливаются из индифферентных металлов, не вступающих в химическое взаимодействие с компонентами раствора оксред-системы. Обычно применяют цла-тину, золото, иридий в виде пластинки, проволоки или сетки. Через проволоку из того же металла их впаивают в стеклянную трубку. К этой проволоке приваривают медную проволоку, служащую для подсоединения электрода к измерительной схеме. Перед измерениями электрод либо поляризуют попеременно катодным и анодным током, либо обрабатывают электрод горячими растворами азотной кислоты или хромовой смесью, а затем 10 % - й щелочью. [15]
Страницы: 1 2 3 4