Измерение - равновесный потенциал
Cтраница 2
Тем не менее константа нестойкости комплексного иона, вычисленная по измерениям равновесных потенциалов, является некоторой объективной характеристикой комплекса; поэтому мы провели вычисления такого рода. [16]
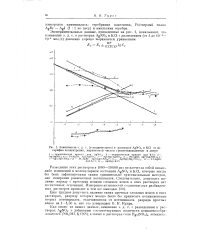 |
Зависимость э. д. с. ( в милливольтах в растворах AgN03 и КС1 от логарифма концентрации, выраженной числом грамм-эквивалентов в литре. [17] |
Разведение этих растворов в 1000 - 10 000 раз не влечет за собой каких-либо изменений в молекулярном состоянии AgN03 и КС1, которые могли бы быть зафиксированы таким сравнительно чувствительным методом, как измерение равновесных потенциалов. [18]
Поверхность катода покрывают медью непосредственно из исследуемого электролита при плотности тока 0 001 А / см2 в течение 5 мин. Снимать поляризационную кривую начинают с измерения равновесного потенциала. [19]
Причиной возникновения концентрационной поляризации является обеднение поверхностного слоя электроактивным веществом, расходующимся в электрохимической реакции, из-за медленной диффузии его из глубины раствора. Поскольку из-за концентрационной поляризации измеренный Ер, всегда ниже действительного, в методах, основанных на измерении равновесного потенциала, концентрационную поляризацию необходимо свести к минимуму, снижая плотность тока и перемешивая раствор. Однако концентрационная поляризация может быть основой электрохимических методов. В этом случае ( вольтамперометрические методы) стремятся создать условия для ее максимального проявления за счет высокой плотности тока на индикаторном электроде и проведения измерений в разбавленном неперемешиваемом растворе. [20]
 |
Поляризационная кривая для необратимой окислительно-восстановительной системы. [21] |
Поляризационная кривая для необратимой электрохимической системы приведена на рис. 10.9. От кривой, изображенной на рис. 10.8, ее отличают три важных момента. В следующих разделах будет показано, что такие системы нельзя использовать в методах, основанных на измерении равновесного потенциала. Эти системы неудобны и для методов, основанных на измерении тока. [22]
 |
Значение рН водных вытяжек. [23] |
Поскольку определить истинные значения рН весьма трудно, необходимы дополнительные химические анализы, чтобы судить о способности поровой жидкости бетона пассивировать или активировать сталь. Особый интерес представляют методы непосредственной оценки электрохимического состояния стали в бетоне. Такими методами являются измерение равновесных потенциалов и снятие поляризационных кривых стали в бетоне. [24]
Для получения токовых политерм i - Г - кривых исследуемого процесса снимают поляризационные кривые через каждые 10 С в указанном выше интервале температур. Перед каждым новым опытом устанавливают необходимую температуру и заново покрывают поверхность платинового катода соответствующим металлом. Снимать поляризационные кривые начинают с измерения равновесного потенциала; кривая должна быть построена на основании 8 - 10 экспериментальных точек. [25]
 |
Поляризация молибденового. [26] |
Подготовка опытов была аналогична, как для измерений равновесных потенциалов. [27]
Мы изучали отдельные электродные реакции, но этот идеальный случай реализуется не всегда. В этом случае потенциал разомкнутой цепи не является равновесным потенциалом, соответствующим какой-либо из этих реакций, но является смешанным или коррозионным потенциалом. При разомкнутой цепи равновесия нет - одна реакция протекает в анодном направлении, а другая - в катодном, так что полная плотность тока равна нулю. Таким образом, даже следы примесей могут затруднить измерение равновесного потенциала кислородного электрода ( разд. [28]
Мы изучали отдельные электродные реакции, но этот идеальный случай реализуется не всегда. В этом случае потенциал разомкнутой цепи не является равновесным потенциалом, соответствующим какой-либо из - этих реакций, но является смешанным или коррозионным потенциалом. При разомкнутой цепи равновесия нет - одна реакция протекает в анодном направлении, а другая - в катодном, так что полная плотность тока равна нулю. Таким образом, даже следы примесей могут затруднить измерение равновесного потенциала кислородного электрода ( разд. [29]
Основное внимание в современной электрохимии уделяется изучению скоростей реакций и равновесий, которые имеют место на границе раздела электрод - раствор электролита, изучению строения и свойств этой границы раздела, а также строения и свойств растворов электролитов. Равновесия и кинетику реакций на электродах чаще всего изучают, используя гальванические элементы, составленные из металлов и водных растворов электролитов, которые и будут в основном рассматриваться в дальнейшем. Исследования равновесных потенциалов электродов в гальванических элементах позволяют установить состав и концентрацию частиц, участвующих в электродной реакции. Подобные исследования там, где они возможны, должны предшествовать изучению кинетики электродных процессов. Измерения равновесных потенциалов электродов часто проводят для установления состава и термодинамической устойчивости различных ассоциатов, образующихся в растворах, и подобные исследования представляют самостоятельный интерес. [30]
Страницы: 1 2