Анион - хлорид
Cтраница 1
Анионы хлорида, как это уже отмечалось выше, занимают наиболее активные в адсорбционном отношении места и несколько нивелируют энергетическую характеристику поверхности металла. [2]
Установлено, что только анионы хлоридов, бромидов и иодидов ускоряют КР титановых сплавов. Электролит в трещине становится кислым ( экспериментально подтверждено [109]); ионы водорода и Ti 3 вытесняются другими катионами внутри трещины таким образом, что скорость не зависит от присутствия в среде катионов щелочных и щелочноземельных металлов. Определенные катионы тяжелых металлов, таких как медь, в виде хлорида могут ингибировать процесс КР в условиях без на ложения потенциала, поскольку ионы меди способствуют в хло-ридных растворах установлению потенциала в области анодной защиты. [3]
Измерению не мешают катионы меди, железа, цинка, свинца и кадмия; анионы хлорида, нитрата, сульфата и фосфата. [4]
 |
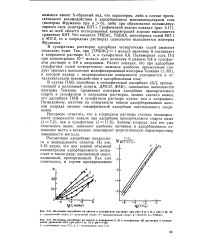
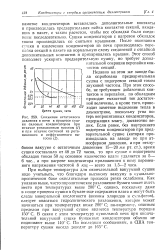
Анодные поляризационные кривые железного электрода в кислых хлоридных растворах. [5] |
Анодное растворение железа в кислых хлоридных растворах имеет ряд характерных особенностей, что связано с участием в процессе анионов хлорида. Рассмотрим анодное растворение железа в присутствии БД и ТМБАП. То же самое наблюдается и в случае других ацетиленовых ингибиторов. [6]
Из сопоставления данных табл. 1.1 для хлоридных и сульфатных растворов видно, что в сульфатных средах параметры катодного процесса ближе к требованиям разрядного механизма, чем в хлоридных. Наличие в растворе анионов хлорида несколько уменьшает зависимость скорости катодного процесса и перенапряжения водорода от рН среды. [8]
Реакции окисления хорошо протекают, если носителем служит окись алюминия, в то время как реакции восстановления идут лучше, если в-качестве носителя взят кварцевый песок. Периодат калия легко окисляет анион хлорида в сильнокислом растворе, а персульфат аммония почти не окисляет его. Выбор носителя является также важным фактором при составлении окислительных смесей. Например, если анализируемый раствор содержит ионы двухвалентного железа и трехвалентного хрома, то для их разделения следует применить в качестве носителя окись алюминия в анионной форме. [9]
 |
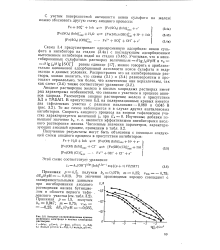
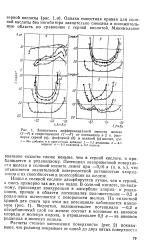
Изотермы адсорбции на железе в 1 М HCI.| Изотермы адсорбции на - т - О стали Ст3 в М НС1. [10] |
Обращает на себя внимание уменьшение энергетической неоднородности поверхности железа при переходе от сульфатного раствора к хло-ридному. Это, безусловно, связано с адсорбцией анионов хлорида, занимающих наиболее активные места и тем самым как бы выравнивающих энергетическую неоднородность отдельных мест на поверхности. Следует отметить также более четкое выполнение изотермы Фрумкина при адсорбции органических катионов ТМБАП и МП-1. В хло-ридном растворе адсорбция этих катионов идет по поверхности, на которой уже имеются адсорбированные анионы хлорида, что обусловливает электростатический характер адсорбционного взаимодействия. [11]
Катионы металлов обычно значительно легче образуют комплексы с неорганическими анионами в органических растворителях, чем в воде. Например, для перевода розового катиона кобальта ( II) в голубой анион хлорида кобальта ( If) необходима 4 - 5 М хлористоводородная кислота. В растворе с преобладающим содержанием ацетона интенсивное голубое окрашивание в присутствии кобальта ( II) образуется в очень разбавленной хлористоводородной кислоте. Таким образом, область применения ионообменного группового разделения существенно расширяется, если его проводить в смеси воды с органическим растворителем. [12]
 |
Снижение остаточного давления в печи в процессе сушки силовых конденсаторов при откачке ротационным насосом ( 1 и при откачке системой из ротационного и диффузионного насосов ( 2. [13] |
При выборе температуры для окончательной вакуумной сушки надо учитывать, что благодаря высокому вакууму в сушильно-пропиточном баке окислительные процессы резко ослаблены. Как указано выше, чисто пиролитическое разложение бумаги может иметь место при температурах выше 200 С, однако, поскольку даже в конце процесса сушки в бумаге еще содержится влага и могут быть следы минеральной кислотности ( анионы хлоридов и сульфатов), следует опасаться гидролитического разложения, которое может начинаться при температурах ниже 200 С; по-видимому, опасным пределом при вакуумной сушке является температура порядка 150 С. В связи с этим температуру сушильной печи при окончательной вакуумной сушке бумажных конденсаторов обычно не поднимают выше 140 С. По последним сообщениям, в США температуру сушки иногда доводят до 165 С. [14]
 |
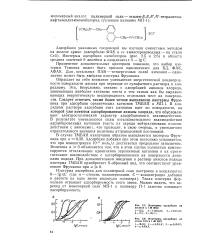
Зависимость дифференциальной емкости железа ( 1 - 4 и сопротивления ( / - 4 от потенциала в 2 н. растворах серной ( а, фосфорной ( б и соляной ( в кислот, г / л. [15] |
Страницы: 1 2