Анион - элемент
Cтраница 1
 |
Поляризация аниона. [1] |
Анионы элементов одной группы при перемещении сверху вниз вдоль нее приобретают все большие размеры и все большую поляризуемость. Хотя в рядах такого типа ионный заряд остается постоянным, увеличение поляризуемости обусловливается тем, что этот заряд оказывается распределенным в последовательно возрастающем объеме. Например, I - поляризуется значительно легче, чем F -, так как первый из этих ионов намного больше второго. Электрическое поле катиона Ag поляризует иодид-ион в гораздо большей степени по сравнению с тем, как оно поляризует намного меньшие по размерам хлорид - и фторид-ионы. Многие иодиды других элементов также обладают преимущественно-ковалентным характером, в то время как фториды и хлориды соответствующих элементов оказываются гораздо более ионными соединениями. [2]
Анионы элементов 2-го периода плоские - BOi -, СОЗ, МОГ; типы симметрии - линейные, согнутые, треугольные, тетраэдри-ческие. Анионы элементов 3-го периода SiOl, PO -, SOt, СЮГ - только тетраэдрические; типы симметрии - тетраэдры, октаэдры. [3]
Анионы элементов 2-го периода плоские - BOi -, СОЗ, МОГ; типы симметрии - линейные, согнутые, треугольные, тетраэдри-ческие. Анионы элементов 3-го периода SiOl, PO -, SOt, С1ОГ - только тетраэдрические; типы симметрии - тетраэдры, октаэдры. [4]
Почему анионы элементов VI группы обладают большими размерами, чем соответствующие изоэлектронные анионы элементов VII группы. [5]
У анионов элементов одного периода увеличение радиуса с ростом отрицательного заряда невелико. [6]
К их числу относятся анионы элементов В-подгрупп ( разд. [7]
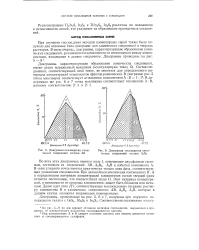 |
Диаграмма соосаждения химических соединений состава АВ.| Диаграмма соосаждения химических соединений состава А Вз. [8] |
Под компонентами А и В следует понимать катионы или анионы элементов основного и соосаждающегося сульфидов. [9]
Почему анионы элементов VI группы обладают большими размерами, чем соответствующие изоэлектронные анионы элементов VII группы. [10]
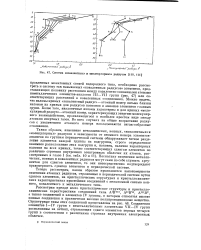 |
Система ковалентных и молекулярных радиусов [ НО, 111 ]. [11] |
Можно видеть, что изломы кривых ковалентный радиус-атомный номер весьма близки изломам на кривых для радиусов катионов и анионов элементов главных групп. Более того, аналогичные изломы характерны и для кривых молекулярный радиус-атомный номер, характеризующих энергию молекулярного взаимодействия, проявляющегося в наиболее простом виде между атомами инертных газов. Во всех случаях на общее возрастание радиусов с увеличением атомного номера накладываются зигзагообразные отклонения. [12]
Анионы элементов 2-го периода плоские - BOi -, СОЗ, МОГ; типы симметрии - линейные, согнутые, треугольные, тетраэдри-ческие. Анионы элементов 3-го периода SiOl, PO -, SOt, СЮГ - только тетраэдрические; типы симметрии - тетраэдры, октаэдры. [13]
Анионы элементов 2-го периода плоские - BOi -, СОЗ, МОГ; типы симметрии - линейные, согнутые, треугольные, тетраэдри-ческие. Анионы элементов 3-го периода SiOl, PO -, SOt, С1ОГ - только тетраэдрические; типы симметрии - тетраэдры, октаэдры. [14]
 |
Рентгеновские спектры С1С4 -. [15] |
Страницы: 1 2