Малый анион
Cтраница 1
Сольватация малых анионов определяется прежде всего наличием и прочностью водородных связей типа А - - HS. Прочность водородных связей возрастает при усилении основности малых анионов. [1]
Поведение малых анионов ( такие данные на рисунке не приведены) полностью аналогично поведению катионов. Уменьшение & Htr выражено для анионов сильнее. Эта закономерность может быть следствием стабилизирующих дисперсионных сил, действующих между ионом и растворителем, которые более существенны в случае поляризуемых органических растворителей, чем для воды, причем их влияние усиливается с ростом ионного радиуса. ДСг не распространяется на большие органические ионы. [2]
Особенно значительны эти различия в случае малых анионов, которые плохо сольватированы в апротонных растворителях. [3]
Промежуточное место занимают соли четвертичных аммониевых оснований с малыми анионами, соли третичных аммониевых оснований с малыми анионами и соли третичных аммониевых оснований с большими анионами. [4]
 |
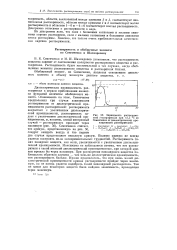
Константы скорости реакции СН1 Х - СН3Х Г в СН3ОН и ДМФ. [5] |
Из табл. 2.36 очевидно, что порядок изменения нуклеофильности малых анионов почти полностью обращается при переходе из протонных в диполярные апротонные растворители. Ионная ассоциация может скрывать эту перестановку ( гл. HS ( 1 - Вг - С1 - F -) отражает тогда инверсию либо степени делокализации заряда, либо ряда изменения энергии сольватации. [6]
Промежуточное место занимают соли четвертичных аммониевых оснований, с малыми анионами и соли третичных аммониевых оснований, с большими анионами. [7]
 |
Зависимость растворимо-стей о-нитрофенола при 15 5 С по Семенченко от диэлектрической проницаемости растворителей. [8] |
Из диаграммы ясно, что соли с большими катионами и малыми анионами хорошо растворимы, соли с малыми катионами и большими анионами плохо растворимы. Конечно, это только очень приблизительная качественная картина растворимости. [9]
И поскольку концентрация Li в фазе внешнего раствора больше, чем в фазе ионита, малые анионы галогенов сосредоточиваются в фазе раствора. [10]
И поскольку концентрация Li 1 в фазе внешнего раствора больше, чем в фазе ионита, малые анионы галогенов сосредоточиваются в фазе раствора. [11]
Промежуточное место занимают соли четвертичных аммониевых оснований с малыми анионами, соли третичных аммониевых оснований с малыми анионами и соли третичных аммониевых оснований с большими анионами. [12]
Плотная положительная сольватиая оболочка ( например, из молекул воды, ориентированных атомами водорода к иону) протонных растворителей понижает ВЗМО малых анионов. Отрицательная сольватиая оболочка ( молекулы соды ориентированы атомами кислорода к иону) повышает энергию НСМО малых катионов. Кроме того, малые ионы приобретают жесткость в начале кислотно-основной реакции при прямом взаимодействии с партнером, электростатическое поле которого оказывает стабилизирующее влияние, подобно влиянию протонных растворителей. [13]
Так как образование ионных пар тем вероятнее, чем меньше размеры катиона и аниона, реакционная способность уменьшается в наибольшей степени именно для солей с малыми анионами. [14]
При пропускании раствора соли через анионит в ОН-форме получается раствор основания, при нейтрализации которого могут быть получены различные соли. Соли с малыми анионами ( р -, СГ, NOs, SC4 -) легко растворимы в воде и кристаллизуются из нее в виде кристаллогидратов. Безводные соли получаются при перекристаллизации гидратов из ацетонитрила или хлороформа. [15]
Страницы: 1 2