Карбонатный анион
Cтраница 1
Карбонатный анион дает растворимые соли только с одновалентными, катионами. С двухвалентными катионами он образует труднорастворимые соединения, а следовательно, и хорошо химически поглощается почвой. Бикарбонатный анион и с одновалентными и с - двухвалентными катионами образует растворимые в воде соли. [1]
Для отделения от главной массы цинка галлий в виде комплексного карбонатного аниона поглощается анионитом ЭДЭ-10П в форме СО32 -, а цинк в виде комплексного катиона проходит в фильтрат. [2]
Для отделения от главной массы цинка галлий в виде комплексного карбонатного аниона поглощается анионитом ЭДЭ-10П в форме СО32 - -, а цинк в виде комплексного катиона проходит в фильтрат. [3]
Гидратная щелочность обусловлена концентрацией в воде гидроксильных анионов ОН, карбонатная щелочность - карбонатных анионов СОз и бикарбонатная - анионов НСОз. Особое значение имеет содержание в воде гидратной щелочности, которая агрессивно воздействует на металл поверхностей нагрева. [4]
В зависимости от содержания анионов, характеризующих щелочность, различают: гидратную щелочность, обусловленную концентрацией гидроксильных анионов; карбонатную, обусловленную концентрацией карбонатных анионов; бикарбонатную, обусловленную концентрацией бикарбонатных анионов. Щелочность измеряется в мкг-экв / кг или мг-экв / кг. [5]
Если присутствие карбонатных анионов в среде и влияет на состав системы компо-гентов угольной кислоты внутри клетки, то это влияние по край-юй мере значительно слабее влияния молекул свободной двуокиси углерода. Другими словами, присутствие огромного избытка ионов НСОГ и СОз существенно не злияет на насыщение двуокисью углерода, которое будет опреде-тяться только концентрациями ее молекул. [6]
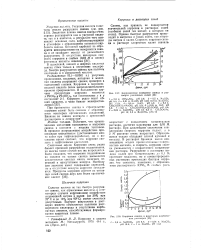 |
Коррозионное поведение свинца в растворах различных солей.| Коррозия свинца в некоторых карбонатных растворах. [7] |
Сильные щелочи не так быстро разрушают свинец, как агрессивные кислоты, и в некоторых случаях коррозионное воздействие гидроокисей натрия и калия ( до 30 % при 25 С и до 10 % при 90 С) может считаться допустимым. Быстрое разрушение в растворах извести объясняется наличием растворенного кислорода и отсутствием карбонатных анионов, способствующих формированию защитных пленок. [8]
Приведенные ниже производные бензотиздиазина понижают кровяное давление или являются мочегонными средствами, обладающими высокой эффективностью. Считают, что политиазид выводит из почек катионы натрия и анионы хлора, почти не нарушая обмена катионов калия и карбонатных анионов. Там же приведены другие фтор-содержащие препараты этого типа. [9]
Щелочностью воды называют суммарное содержание в ней гидроксильных, карбонатных, бикарбонатных и других анионов. В зависимости от содержания анионов, характеризующих щелочность, различают: гидратную щелочность, обусловленную концентрацией гидроксильных анионов; карбонатную, обусловленную концентрацией карбонатных анионов; бикарбонатную, обусловленную концентрацией бикарбонатных анионов. Щелочность измеряется в мкг-экв / кг или мг-экв / кг. [10]
Количества растворимых карбонатов ( предположительно щелочных карбонатов), найденные Бертло и Андре, кажутся слишком высокими, если принять во внимание сравнительно низкий рН клеточного сока. Эти данные не согласуются также с количеством двуокиси углерода, которую листья поглощают при повышенном ее давлении и отдают в вакууме. Недавние исследования позволяют предположить, что все находимые в листьях карбонатные анионы соответствуют двухвалентным катионам. [11]
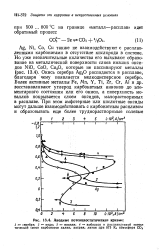 |
Анодные потенциостатические кривые. [12] |
Си также не взаимодействуют с расплавленными карбонатами в отсутствие кислорода в системе. Окись серебра Ag2O распадается в расплаве, благодаря чему появляется мелкодисперсное серебро. Более активные металлы Fe, Мп, Y, Ti, Zr, Cr, A1 и др. восстанавливают углерод карбонатных анионов до элементарного состояния или его окиси, а поверхность металлов покрывается слоем оксидов, малорастворимых в расплаве. [13]
Повышение температуры способствует образованию эмульсии, понижению вязкости раствора. Межповерхностное натяжение также уменьшается с повышением температуры, что способствует образованию эмульсии. Однако эмульсия образуется главным образом путем добавки в раствор специальных веществ - так называемых э м у л ь г а т о р о в. Для обезжиривающих растворов акими эмульгаторами являются мыло, органические сульфокислоты, гидроксильные, фосфатные и карбонатные анионы. [14]
По мнению Виллемса [48, 50], существенную роль при кристаллизации органических веществ на неорганических подложках играет способность к образованию водородных мостиков между молекулами осадка и подложки. Чтобы объяснить это, рассмотрим осаждение различных фенолов на карбонатах ряда известковых шпатов. В этом случае эпитаксия получена при кристаллизации - гидрохинона, р-гидроксидифенила, 3-гидроксипирена. С другой стороны, нафтазарин, а-глюкоза, янтарная и салициловая кислоты не дают ориентированных выделений при осаждении из растворов на кальците и других шпатах. Интересно отметить, что в последнем случае вещества образуют в растворе ионы и, таким образом, удовлетворяют условию Руайе - Фриде-ля. Поведение этих двух типов веществ Виллемс объясняет различием свойств водородных атомов, входящих в гидроксильные группы. У гидрохинона и других органических веществ водород гидроксильных групп способен присоединяться к атомам подложки с образованием водородного мостика. Стремление к образованию водородной связи максимально между атомами О и О или О и N, оно мало между N и N, S и С1 и др. У шпатов водородные мостики могут осуществляться через кислород карбонатных анионов. [15]
Страницы: 1