Воздействие - реакционная среда
Cтраница 2
В работе [104] предполагалось, что катализатор синтеза метанола под воздействием реакционной среды в процессе формирования приобретает две формы - окисленную и восстановленную. При адсорбции оксида углерода на окисленных центрах образуется метанол, а при адсорбции на восстановленных центрах - спирты и углеводороды. В процессе формирования и эксплуатации, а также под воздействием реакционной среды на поверхности катализатора меняется соотношение окисленных и восстановленных активных центров. [16]
Эффективность нестационарных способов проведения каталитических процессов обусловлена двумя факторами: воздействием реакционной среды на катализатор и использованием инерционных свойств каталитического реактора в целом. [17]
Приведенные примеры убедительно показывают что на различных стадиях приготовления катализаторов а также под воздействием реакционной среды происходят как качественные так и количественные изменения состава поверхности: восстановление-окисле-кие образование поверхностных комплексов сплавов на носителях, обогащение или обеднение поверхности определенными компонентами. [18]
По-видимому, среди большого количества гетерогенных каталитических процессов изменения свойств оксидных катализаторов под воздействием реакционной среды изучены наиболее подробно. Это относится прежде всего к катализаторам окислительно-восстановительных реакций при вариации соотношения концентраций окисляющего и восстанавливающего компонентов в реакционной смеси. С уменьшением этого отношения снижается окисленность катализатора, и в результате наблюдается резкое уменьшение общей скорости реакции при одновременном увеличении селективности в отношении продуктов неполного окисления. Изменение этих параметров на примере реакции окисления акролеина в акриловую кислоту на оксидном ванадиймолибденовом катализаторе [11] представлено на рис. 1.4. Кривая 3 показывает, как меняется с изменением состава реакционной смеси энергия связи кислорода на поверхности катализатора, определяющая каталитические свойства. [19]
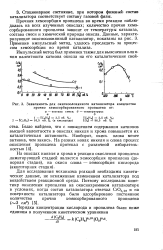 |
Зависимость для окиснооловянного катализатора количества прочно хемосорбированного пропилена от. [20] |
Для исследования механизма реакций необходимы кинетические данные, не искаженные изменением катализатора под воздействием реакционной среды. [21]
Эффект от нестационарного способа осуществления гетерогенного каталитического процесса может быть обусловлен двумя основными факторами: воздействием реакционной среды на катализатор и динамическими свойствами каталитического реактора в целом. [22]
Однако даже для одного из наиболее распространенных катализаторов окисления - пяти-окиси ванадия - процесс ее изменения под воздействием реакционной среды изучен недостаточно. Степень восстановления V2O5 в ходе катализа является функцией концентрации восстановителя ( окисляющегося вещества) [6], но вопрос о том, какова оптимальная величина этой степени восстановления данным веществом для получения максимальных выходов продуктов его мягкого окисления, для большинства случаев является дискуссионным. В работе В. А. Ройтера и В. А. Юзы [4] выдвинута электронно-химическая схема действия V2O5, которая рассматривает каталитическую реакцию окисления ( водорода, углеводородов и пр. [23]
Кинетическая модель процесса представляет собой систему ин-тегродифференциальных и алгебраических уравнений, которые передают количественную динамику каталитического цикла и воздействие реакционной среды на катализатор. [24]
 |
Зависимость выхода метилакролеина ( МА ( 1 и СО2 ( 2 от концентрации О2 в импульсе. [25] |
Кинетические уравнения реакций глубокого окисления органических веществ ( как и других каталитических реакций), выведенные без учета воздействия реакционной среды на катализатор, не отражают действительного механизма каталитической реакции. Даже хорошее соответствие рассчитанных по этим уравнениям и экспериментально определенных скоростей реакций не может рассматриваться как подтверждение справедливости представлений о механизме рассматриваемой реакции, использованных при выводе этих уравнений, пока не будет установлена идентичность кинетики реакции для стационарного и нестационарного состояния катализатора. [26]
В основных аппаратах опытной установки были проведены испытания образцов различных сталей с целью определения скорости их коррозии под воздействием реакционной среды. Результаты исследований 68 показали, что наибольшей коррозии были подвержены образцы, помещенные в дистилляционный куб и отдувочную колонну, где поддерживалась наиболее высокая температура. В этих аппаратах наименьшая скорость коррозии была найдена для сталей с пониженным содержанием углерода и с повышенным содержанием никеля, а также для сталей, легированных ниобием. В остальных аппаратах опытной установки, где условия ведения процесса были значительно мягче, разницы в коррозионном поведении сталей ОХ18Н9, Х17Н5Г9АБ ( ЭП-55), 1Х18Н9Т, Х23Н13, Х18Н11Б, Х19Н14Б и Х21Н14Б обнаружено не было. [27]
Отличие W от г в нестационарном режиме обусловлено динамическими свойствами катализатора, связанными с релаксационными характеристиками каталитического цикла и воздействием реакционной среды на катализатор. [28]
С целью достижения максимального эффекта при минимальном расходе активного компонента, увеличения его поверхности и придания катализатору требуемой механической прочности и устойчивости к воздействию реакционной среды были применены катализаторы на носителях. [29]
Здесь система уравнений ( 1.7 а) передает динамику каталитического цикла; 0 - вектор концентрации веществ на поверхности катализатора; х - вектор изменяющихся под воздействием реакционной среды характеристик катализатора. Система уравнений (1.76) передает динамику изменения состояния катализатора под воздействием реакционной среды. [30]
Страницы: 1 2 3 4