Четырехзарядный анион
Cтраница 1
Четырехзарядный анион этой кислоты может занять шесть координационных мест за счет координации четырех карбоксильных кислородов и двух атомов азота. [1]
Как четырехзарядный анион ( АТФ4 -), так и монопротониро-ванная форма ( АТФН3) образуют в растворе комплексы с ионами металлов. Результаты исследований с помощью многочисленных экспериментальных методов [42] показывают, что ионы металлов ( за исключением Си2) координируются с трифосфатной частью АТФ. Этот вывод подтверждается константами устойчивости комплексов аналогичных нуклеотидов, содержащих различные пуриновые и пи-римидиновые основания; эти константы мало зависят от природы основания, содержащегося в молекуле. Более того, константы устойчивости повышаются при увеличении числа фосфатных групп. [2]
В виде депротоннрованных четырехзарядных анионов Y4 - ЭДТА присутствует только в снльнощелочных растворах с рН 10 - 12 ( см. рнс. [3]
Наиболее известным комплексообразующим веществом такого типа является этилендиаминтетрауксусная кислота ( EDTA) XXV, четырехзарядный анион которой может вести себя как пента - или гексадентатный лиганд. EDTA координирует ион металла двумя атомами азота и тремя или четырьмя карбоксильными группами с образованием октаэдрических комплексов, значительно стабилизированных за счет возникновения пятичлен-ных хелатных циклов. [4]
Пентадентатные комплексы кобальта с этилендиаминтетра-уксусной кислотой Na [ CoHY ] X, где Y - четырехзарядный анион ЭДТА, X - С1 -, Вг - или J -, были синтезированы в работе [1104]; были изучены также их инфракрасные спектры. [5]
Переходы окраски его связаны со ступенчатой диссоциацией и образованием анионов различного состава. При рН 1 - 7 образуются двухзарядные анионы, окрашенные в желтый цвет, при рН 7 4 - 10 в растворе находятся трехзарядные анионы фиолетового цвета, а при рН выше 10 - четырехзарядные анионы синего цвета. [6]
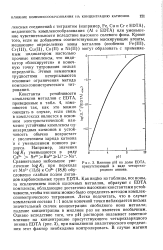 |
Влияние рН на долю EDTA, присутствующей в виде четырехзарядного аниона. [7] |
Константы устойчивости комплексов металлов с EDTA, приведенные в табл. 4, изме-няются так, как это можно ожидать в случае, если связь в комплексах является в основ-ном электростатической: наименее устойчивы комплексы однозарядных катионов и устойчивость обычно возрастает с увеличением заряда катиона и с уменьшением ионного радиуса. Сравнительно небольшое увеличение log / Ci при переходе от Мп2 ( 13 6) к Си2 ( 18 8) обусловлено слабым полем лиган-дов карбоксильных групп EDTA. Как видно из таблицы, все ионыг за исключением ионов щелочных металлов, образуют с EDTA комплексы, обладающие достаточно высокими константами устойчивости, чтобы эти ионы можно было определять методом комплексонометрического титрования. Легко подсчитать, что в случае комплексов состава 1: 1 возле конечной точки наблюдается весьма значительный скачок концентрации свободного иона металла; падение концентрации в миллион раз не является необычным. Однако вследствие того, что рН растворов оказывает заметное влияние на концентрацию присутствующего четырехзарядного аниона EDTA ( рис. 3), при выполнении аналитического определения этот фактор необходимо контролировать. [8]
Страницы: 1