Восстановление - ион - водород
Cтраница 1
Восстановление ионов водорода ( или молекул воды), а также растворенного кислорода ограничивает возможности восстановления других веществ. Вещества, кривая восстановления которых на электроде из металла, применяемого в качестве восстановителя, близка к кривой восстановления ионов водорода, восстанавливаются с одновременным выделением газообразного водорода. Окислители, для которых кривая восстановления на электроде из применяемого металла лежит влево от кривой восстановления ионов Н ( или молекул О2) на том же металле, не могут быть вообще восстановлены этим металлом. [1]
Процесс восстановления ионов водорода, выражаемый суммарной реакцией (1.2), - одна из наиболее интенсивно изучаемых электрохимических реакций. Она служит той моделью, на примере которой установлены общие законы электрохимической кинетики. [2]
Процесс восстановления ионов водорода был предметом весьма многочисленных исследований - в этом отношении с ним не может конкурировать ни одна электродная реакция. [3]
 |
Некоторые типы стационарных ртутных электродов. [4] |
Так как восстановление ионов водорода на ртути связано со значительно более высоким перенапряжением, чем на благородных металлах, особенно широкое применение ртутные электроды нашли в вольтамперометрии. Замена ртути на благородные металлы связана с введением в измерительную систему электродов с шероховатой поверхностью, что приводит к менее воспроизводимым вольт-амперным кривым по сравнению с кривыми, полученными с использованием ртутных электродов. Даже если поверхность твердого электрода отполировать, все равно она далека от идеальной, гладкой поверхности ртути. [5]
Сопротивление процессу восстановления иона водорода ( присоединения электрона и образования молекулы На) является причиной возникновения активационной поляризации. Такая поляризация была названа водородным перенапряжением или перенапряжением выделения водорода. Чем больше перенапря - жение выделения водорода, тем медленнее протекает сопряженный анодный процесс - коррозия металла. Полировка поверхности металла, понижение температуры электролита и увеличение плотности поляризующего тока - все эти факторы влияют на увеличение перенапряжения выделения водорода. [6]
На ртутном электроде восстановление ионов водорода происходит лишь в сильно восстановительных условиях ( кривая сдвинута сильно влево), и поэтому в присутствии ртути ( или при применении амальгам) возможно проведение многих реакций восстановления, которым при отсутствии ртути помешало бы выделение водорода. [7]
В водных растворах восстановление ионов водорода и воды до газообразного водорода является возможным при восстановлении катионов или анионов металла, которые осаждаются на металле. [8]
На ртутном электроде восстановление ионов водорода происходит лишь в сильно восстановительных условиях ( кривая сдвинута сильно влево), и поэтому в присутствии ртути ( или при применении амальгам) возможно проведение многих реакций восстановления, которым при отсутствии ртути помешало бы выделение водорода. [9]
На ртутном электроде восстановление ионов водорода происходит лишь в сильно восстановительных условиях ( кривая сдвинута сильно влево), и поэтому в присутствии ртути ( или при применении амальгам) возможно проведение многих реакций восстановления, которым при отсутствии ртути помешало бы выделение водорода. [10]
Предельный ток волны восстановления ионов водорода является функцией концентрации катализатора. Поэтому такие волны используются для определения ультрамалых количеств ( до Ы ( Г8 моль / л) неорганических и органических соединений. Однако необходимо тщательно контролировать условия эксперимента, поскольку гкет зависит от потенциала и в большинстве случаев волна имеет вид полярограммы с максимумом. С увеличением концентрации катализатора / стремится к предельному значению. Кроме того, / кат зависит от рН, проходя через максимум, положение которого совпадает с рК органического соединения, и от буферной емкости раствора. [11]
При сравнении потенциалов восстановления ионов водорода из растворов хромовой и серной кислот видно, что перенапряжение при выделении водорода из хромовой кислоты выше, чем из серной. Так, при плотности тока 100 ма / см. отличие составляет около 80 мв. [12]
Предельный ток волны восстановления иона водорода является функцией концентрации катализатора. Из представленных данных следует, что при использовании этих волн необходимо тщательно контролировать условия. [13]
Электрохимическая коррозия при сопряженном восстановлении ионов водорода в литературе по коррозии металлов часто называют коррозией с водородной деполяризацией. [14]
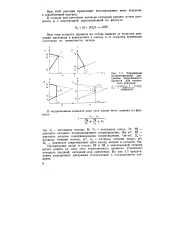 |
Упрощенные поляризационные диаграммы коррозионного процесса для различного контроля. а - катодного. б - анодного. s - омического. г - смешанного. [15] |
Страницы: 1 2 3 4