Восстановление - оксид
Cтраница 2
Применяется восстановление оксидов марганца ( МпО2, Мп3О4) углеродом, кремнием, алюминием. Значительную долю марганца выплавляют в виде ферромарганца ( 60 - 90 % Мп) в электрических печах при восстановлении углем смеси марганцевых и железных руд. [16]
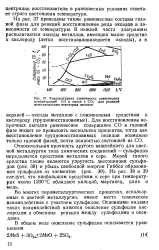 |
Температурная зависимость равновесных концентраций СО в смеси с СО2 для реакций восстановления некоторых оксидов. [17] |
Для восстановления непрочных оксидов равновесное содержание СО в газовой фазе может не превышать нескольких процентов, тогда как восстановление, трудновосстановимых оксидов возможно только газовой фазой, почти полностью состоящей из СО. [18]
Реакции восстановления оксидов начинаются около 200 - 400 С, но в большинстве случаев они идут с небольшими скоростями. Объясняется это не только большой поверхностью порошкообразного металла, но также и тем, что пирофорные металлы, как правило, имеют искаженную кристаллическую решетку, повторяющую в какой-то степени кристаллическую решетку исходного оксида. Перестройка решетки и поверхностное окисление металла приводят к его разогреванию и к самовозгоранию на воздухе. [19]
Возможность восстановления оксидов до металла в водных растворах зависит от индивидуальных свойств оксидов. Например, оксиды Fe, Co, Ni, Cu, Ag, Sb могут быть восстановлены до металла, в то время как оксиды элементов IV - VI групп периодической системы восстанавливаются лишь частично. Возможность восстановления оксида до металла или до промежуточного соединения определяется, с одной стороны, его потенциалом восстановления, а с другой - электрической проводимостью. [20]
Реакции восстановления оксидов водородом наиболее часто используют для получения металлов и некоторых неметаллов в чистом состоянии. Особенность этих реакций в том, что они относятся к равновесным и гетерогенным. Равновесие может быть смещено как в сторону получения металла и паров воды, так п в сторону исходных продуктов, что определяется прочностью восстанавливаемого оксида. [21]
Реакции восстановления оксидов начинаются около 200 - 400 С и в большинстве случаев идут с небольшими скоростями. Объясняется это не только большой поверхностью порошкообразного металла, но также и тем, что пирофорные металлы имеют искаженную кристаллическую решетку, повторяющую в какой-то степени кристаллическую решетку исходного оксида. Перестройка решетки и поверхностное окисление металла приводят к его разогреванию и к самовозгоранию па воздухе. [22]
Катализаторами восстановления оксидов азота аммиаком являются образовавшиеся сульфат и оксид меди. [23]
 |
Схема высокочастотной установки Плутон-4 для синтеза бескислородных керамических материалов. [24] |
Реакция восстановления оксида лантана углеродом в вакууме начинается при температуре 1500 С. Оптимальная температура получения дикарбида лантана составляет 1800 - г 1900 С. [25]
 |
Схема высокочастотной установки Плутон-4 для синтеза бескислородных керамических материалов. [26] |
Реакция восстановления оксида лантана углеродом в вакууме начинается при температуре 1500 С. Оптимальная температура получения дикарбида лантана составляет 1800 - j - 1900 С. [27]
 |
Характеристика низкотемпературных катализаторов. [28] |
Процесс восстановления оксида цинка водородом и оксидом углерода в условиях до температуры 700 К маловероятен, на что указывают значительно положительный изобарно-изотермический потенциал и низкие значения констант рановесия. Триоксид хрома ( хромовый ангидрид) СгОз при разложении полностью переходит в оксид хрома Сг20з только при температуре выше 550 С. [29]
 |
Схема селекткшюй каталитической очистки хвгхл-оных нитрозных. газон от OJ с и дон азота аммиаком. [30] |
Страницы: 1 2 3 4 5