Катодное восстановление - металл
Cтраница 1
Катодное восстановление металлов используется для промышленного получения, а также рафинирования многих металлов. Электролиз в этих случаях проводится обычно в растворах или расплавах электролитов. [1]
Катодному восстановлению металлов в органических средах в общем случае могут соответствовать анодный процесс ионизации металла, разряда анионов ( фона или специальных добавок), окисление растворителя. [2]
При катодном восстановлении металлов, способных растворять атомарный водород, происходит их наводороживание. Поглощение водорода создает значительные искажения кристаллической решетки и резко ухудшает механические свойства металла. [3]
При катодном восстановлении металлов и сплавов готовые изделия или полуфабрикаты помещают в электролит, содержащий простые или комплексные ионы осаждаемого металла и соединяют с отрицательным полюсом источника постоянного тока. Покрываемые детали завешивают на катодную штангу гальванической ванны, а на анодную - пластины или прутки из того металла, которым покрывают эти детали. [4]
При катодном восстановлении металлов, способных растворять атомарный водород, происходит их наводороживание, Ю. В. Баймаков и М. И. Замоторин, исследуя железо, полученное при помощи электролиза, обнаружили в нем до 9 2 ат. Поглощение водорода создает значительные искажения кристаллической решетки и резко ухудшает механические свойства металла. Последующий нагрев способствует удалению значительной части поглощенного водорода. Электрохимическое поведение железа и никеля, полученных электролизом водных растворов, отличается от поведения тех же металлов после переплавки, во время которой водород удаляется. [5]
Рассмотрим примеры катодного восстановления металлов. [6]
Структура осадка, полученного при катодном восстановлении металла, определяет его технические качества. От гальванических покрытий и осадков, получаемых при электрометаллургических процессах, обычно требуется плотная мелкокристаллическая структура, достигаемая выбором подходящего состава раствора и режима электролиза. [7]
 |
Поляризационные кривые осаждения олова из чистого сульфатного раствора ( / н в присутствии а-наф-тола ( 2, а-нафтола и желатины ( 3. [8] |
Как правило, в присутствии ПАВ скорость реакции катодного восстановления металла уменьшается. Весьма своеобразное действие могут оказывать ПАВ, если их вводить в раствор не в отдельности, а в совокупности. Дальнейшее повышение плот ности тока происходит при значительно более отрицательных потенциалах. При добавлении к а-нафтолу желатины ингибирующее действие добавок на катодный процесс усиливается. [9]
Таким образом, гипотеза об электрохимическом механизме процесса аптокаталитичсского восстановления металла предполагает сопряжение двух независимых электродных реакций, протекающих на одной и той же поверхности: анодного окисления восстановителя и катодного восстановления металла. Однако, как показали дальнейшие исследования, сопряжение парциальных электродных реакций осуществляется довольно сложным образом и характеризуется не только взаимным плиянием друг на друга, mi и влиянием свойств металла-катализатора на эти реакции. Причем свойства каталитической поверхности, к сиою очередь, чувствительны к характеру протекания электродных и химических реакций. [10]
Таким образом, гипотеза об электрохимическом механизме процесса автокаталитического восстановления металла предполагает сопряжение двух независимых электродных реакций, протекающих на одной и той же поверхности: анодного окисления восстановителя и катодного восстановления металла. Однако, как показали дальнейшие исследования, сопряжение парциальных электродных реакций осуществляется довольно сложным образом и характеризуется не только взаимным влиянием друг на друга, но и влиянием свойств металла-катализатора на эти реакции. Причем свойства каталитической поверхности, в свою очередь, чувствительны к характеру протекания электродных и химических реакций. [11]
Таким образом, гипотеза об электрохимическом механизме процесса автокаталитического восстановления металла предполагает сопряжение двух независимых электродных реакций, протекающих на одной и той же поверхности: анодного окисления восстановителя и катодного восстановления металла. Однако, как показали дальнейшие исследования, сопряжение парциальных электродных реакций осуществляется довольно сложным образом и характеризуется не только взаимным влиянием друг на друга, но и влиянием свойств металла-катализатора на эти реакции. Причем свойства каталитической поверхности, п свою очередь, чувствительны к характеру протекания электродных и химических реакций. [12]
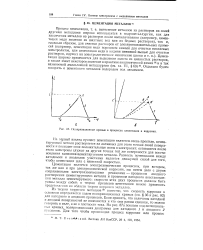 |
Поляризационные кривые в процессах цементации и коррозии. [13] |
Цементация является электрохимическим процессом, при котором, так же как и при электрохимической коррозии, мы имеем дело с двумя сопряженными электрохимическими реакциями - процессом анодного растворения цементирующего металла и процессом катодного восстановления металла цементируемого: скорости этих двух процессов должны быть равны между собой; к теории процессов цементации можно применить представления из области теории коррозии металлов. [14]
Из водных растворов солей металлы могут быть восстановлены электролизом. Катодное восстановление металлов из растворов или расплавов солей называется электрометаллургическим процессом. [15]
Страницы: 1 2