D-аминокислота
Cтраница 1
Некоторые D-аминокислоты при включении их в рацион взамен соответствующих L-изомеров могут поддерживать рост животных и размножение микроорганизмов. В большинстве случаев эти D-изомеры, очевидно, превращаются в L-аминокислоты путем окислительного дезаминирования с образованием а-кето-кислот и последующего реаминирования в результате переами-нирования. Следует подчеркнуть, что такой механизм инверсии D-аминокислот в организме нельзя считать полностью доказанным; однако эти представления находятся в согласии с данными, свидетельствующими о возможности обеспечения роста животных и микроорганизмов при помощи а-кетоаналогов некоторых аминокислот, а также с существованием и широким распространением оксидазы D-аминокислот и различных транс-аминаз. Наблюдения над ростом молодых крыс показали, что вместо D-аминокислот, которые заменяют соответствующие L-аминокислоты, можно вводить в организм и соответствующие а-кетопроизводные. Вместе с тем в некоторых случаях а-кето-кислоты ( например, а-кетоаналоги лейцина и изолейцина) обеспечивают рост молодых животных, тогда как соответствующие им D-аминокислоты не используются растущим организмом; эти данные позволяют предполагать, что скорость окислительного дезаминирования D-аминокислот не всегда достаточно высока, чтобы обеспечить рост животных. [1]
L-и D-аминокислоты различаются, кроме того, по вкусу: первые-горькие, вторые-сладкие. [2]
Определяли следующие D-аминокислоты: D-фенилаланин, - аланин, - валин, - метионин, - лейцин и изолейцин, которые могут вступать в реакции типа ( XI. [3]
Оксидаза D-аминокислот в организме млекопитающих находится только в тканях печени и почек, причем активность ее в почках значительно выше, чем в печени. Фермент окисляет множество различных D-аминокислот и не проявляет поддающейся обнаружению активности по отношению к L-аминокисло-там. В связи с этим следует напомнить, что его используют для обнаружения ничтожных количеств D-аминокислот в присутствии высоких концентраций соответствующих L-изомеров ( стр. [4]
Оксидазы D-аминокислот найдены у ряда плесеней и бактерий; субстратами этих ферментов могут служить встречающиеся в некоторых микроорганизмах D-аминокислоты. [5]
 |
Два эпантиомера аминокислоты аланипа. [6] |
Остатки D-аминокислот обнаружены в немногих простых пептидах, содержащихся в живых организмах. [7]
Оксидаза D-аминокислот с простетической группой ФАД [369] окисляет в соответствующие иминокислоты DL-лейцин, D - и DL-метионин, D - и DL-аланин, DL-a - аминомасляную кислоту. Оксидаза L-аминокислот, содержащая ФАД, дезаминирует L-аргинин в a - кето-б - гуанидовалериановую кислоту, L-орнитин в a - кето-б-аминовалериановую кислоту, L-лизин в г-кето-е-аминокапроновую кислоту. [8]
Остатки D-аминокислот входят в состав многих природных пепти дов, прежде всего антибиотиков В частности, в грамицидин S входит D-фенилаланин, в грамицидин А - D-валин, D-лейцин, D трипто фан, в актиномнцин D D изолейцин, в полимнксин D-серин D-Пролин встречается в эргоалкалоидах. [9]
 |
Два энантиомера аминокислоты аланина. [10] |
Остатки D-аминокислот обнаружены в немногих простых пептидах, содержащихся в живых организмах. [11]
Распространение D-аминокислот пока еще представляется несколько ограниченным. [12]
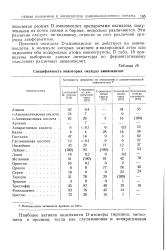 |
Специфичность некоторых оксидаз аминокислот. [13] |
Почечная оксидаза D-аминокислот не действует на аминокислоты, в молекуле которых замещен а-водородный атом или замещены оба водородных атома аминогруппы. В табл. 18 приведены выборочно данные литературы по ферментативному окислению различных аминокислот. [14]
Активность оксидазы D-аминокислот т vivo подтверждается рядом фактов. Например, установлено, что некоторые D-аминокислоты при введении их с пищей вместо соответствующих L-аминокислот обеспечивают рост животных ( стр. [15]
Страницы: 1 2 3 4