Азот - нитрогруппа
Cтраница 3
Для того чтобы нитрогруппы могли повышать стабильность промежуточных структур типа XXXI и тем самым способствовать их образованию, р-орбитали атома азота МО2 - групп должны располагаться параллельно р-орбиталям, принадлежащим расположенным по соседству атомам углерода кольца. Для этого атомы кислорода, связанные с азотом нитрогруппы, также должны лежать приблизительно в плоскости ароматического кольца. Если стерические препятствия мешают атомам кислорода расположиться в этой плоскости, то МО2 - группа становится значительно менее эффективной в смысле стабилизации переходной структуры, поскольку может проявляться только ее индуктивное влияние. [31]
Максимальное количество прореагировавшего озона на 1 моль моно - и динитрофенолов равнялось 5 - 6 моль. При этом в форме нитрат-ионов обнаружено 80 - 90 % азота нитрогрупп. [33]
Следует подчеркнуть, что радикализованная нитрогруппа, - N02, является новым заместителем. Если судить по величинам констант расщепления неспаренного электрона на ядре азота нитрогруппы ( од 2), находимой из спектров ЭПР соответствующих нитроароматических анион-радикалов [16-18], заместитель NOJ принимает участие в сопряжении так же, как другие заместители в ароматических молекулах. [34]
Менее вероятно предположение, что рассматриваемые группы ускоряют заключительный этап реакции - отщепление протона от о-комплекса. При этом акцептор протона В электростатически притягивается к положительно заряженному атому азота нитрогруппы, что облегчает отщепление протона. [35]
Как видно, электроноакцепторная сила нитрогруппы приблизительно вдвое больше, чем группы - C N. Более электроотрицательные ( и полностью идентичные) атомы кислорода оттягивают от атома азота нитрогруппы основную часть электронной плотности, подобно тому, как это наблюдалось в карбонильной группе. Кроме того, в соответствии с правилом октета, , азот не может иметь валентность больше четырех. Поэтому один из атомов кислорода связан с атомом азота семиполярно, вследствие чего на атоме азота имеется полный положительный заряд, отрицательный же заряд равномерно распределяется между обоими атомами кислорода. [36]
 |
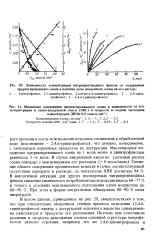
Влияние эффекта сопряжения на растворимость производных бензола с гидрофильными заместителями. [37] |
К тому же в случае анилина понижение электронной плотности в ароматическом кольце за счет оттягивания ее к азоту нитрогруппы более сильное, чем в молекуле фенола, из-за большей величины эффекта сопряжения NH2 - rpynnbi по сравнению с ОН-группой. [38]
Найдено [7], что скорость обмена между нитробензолами и соответствующими радикал-анионами уменьшается при увеличении расщепления непарного электрона на ядре азота нитрогруппы в спектрах ЭПР. [39]
Химия нитросоединений во многом сходна с химией нитрозосоединений, поскольку и нитро - и нитрозогруппы являются ненасыщенными, проявляют - - / - и - М - эффекты и склонны к таутомерии в определенных условиях. Однако нитросоединения в общем более устойчивы, чем нитрозопроизводные, что-объясняется двумя фактами: отсутствием свободной пары на атоме азота нитрогруппы, в результате чего не наблюдается образования димеров для насыщенных и ароматических нитросоединений, и мезомерией самой нитрогруппы, которая придает устойчивость нитро-форме по сравнению с тауто-мерной формой нитроновой кислоты. Большая устойчивость нитросоединенийг особенно проявляется в том, что, если а, - ненасыщенные нитрозосоеди-нения практически неизвестны, а р-ненасыщенные нитросоединения являются достаточно устойчивыми и их химическое поведение интенсивно изучается. Тем не менее, многие из простейших производных нитроалкенов очень-легко полимеризуются, и эта реакция катализируется как водой, так и основанием, и может протекать настолько бурно, что может оказаться опасной. [40]
Химия нитросоединений во многом сходна с химией нитрозосоединений, поскольку и нитро - и нитрозогруппы являются ненасыщенными, проявляют - / - и - М - эффекты и склонны к таутомерии в определенных условиях. Однако нитросоединения в общем более устойчивы, чем нитрозопроизводные, что объясняется двумя фактами: отсутствием свободной пары на атоме азота нитрогруппы, в результате чего не наблюдается образования димеров для насыщенных и ароматических нитросоединений, и мезомерией самой нитрогруппы, которая придает устойчивость нитро-форме по сравнению с тауто-мерной формой нитроновой кислоты. Большая устойчивость нитросоединений особенно проявляется в том, что, если а [ 1-ненасыщенные нитрозосоеди-нения практически неизвестны, а р-ненасыщенные нитросоединения являются достаточно устойчивыми и их химическое поведение интенсивно изучается. Тем не менее, многие из простейших производных нитроалкенов очень легко полимеризуются, и эта реакция катализируется как водой, так и основанием, и может протекать настолько бурно, что может оказаться опасной. [41]
Атом серы в сульфогруппе также становится электрофиль-ньш ( стремящимся реализовать свою максимальную ковалент-ность, как показано в гл. Наличие этих кислотных радикалов в ароматической системе приводит к нейтрализации внутри молекулы. Например, электрофильный азот нитрогруппы ведет себя как кислота и приобретает долю в обладании электронной парой, принадлежащей фенильной группе. [42]
В начале и конце ряда стоят группы СВг3 и CFs, обладающие свойством сильно оттягивать электроны, так что трудно усмотреть какую-нибудь связь частоты с химическими факторами. Спиннер указывает на резкие различия между поведением этих частот и частот колебаний vs и vns группы SO2, у которой существует прямая зависимость между частотами. У сульфона при валентных колебаниях амплитуда тяжелого атома серы мала, и в результате этого эффекты взаимодействия с соседними связями минимальны. Здесь, как и в случае колебаний атома азота нитрогруппы, направление движения углерода при симметричном колебании совпадает с направлением связи замещающей группы. Поэтому следует предполагать, что эффекты связи колебаний будут гораздо больше влиять на симметричное колебание, чем на антисимметричное колебание, при котором движение центрального атома углерода не вызывает такой же деформации связи С - X. По этой причине следует ожидать, что частота симметричного колебания будет меняться по закону, который не может быть просто предсказан на основании рассмотрения химических свойств соединения. [43]
Страницы: 1 2 3