Элементарный азот
Cтраница 1
Элементарный азот реагирует при комнатной температуре с образованием аминокислот и белков в клубеньках некоторых растений. Реакцию катализируют ферменты, а энергию, необходимую для эндотермических процессов, обеспечивает фотосинтез. Химия этого процесса фиксации азота растениями не известна. Полученные в настоящее время данные указывают на то, что катализирующие этот процесс ферменты содержат железо или молибден в двух различных центрах. [1]
Элементарный азот в природе содержится в атмосфере, составляя 78 % ее объема. При О С и давлении 1 атм литр азота весит 1 2506 г. Газообразный азот конденсируется в бесцветную жидкость при - 195 8 С и в белое твердое вещество при - 209 96 С. Азот слабо растворим в воде; при О С и 1 атм в 1 л воды растворяется 23 5 мл газообразного азота. [2]
Элементарный азот содержится в атмосфере, составляя 78 % ее объема. При О С и давлении 1 атм литр азота весит 1 2506 г. Газообразный азот превращается в бесцветную жидкость при - 195 8 С и в белое твердое вещество при - 209 96 С. Азот слабо растворим в воде: при О С и 1 атм в 1 л воды растворяется 23 5 мл газообразного азота. [3]
Элементарный азот, запасы которого в земной атмосфере составляют около 4 X1016 т ( около 8 млн. т на каждый квадратный километр земной поверхности), известен своей химической инертностью. Но коль скоро азот вступает в химическое соединение с другими элементами, он становится способным к разнообразным реакциям и к осуществлению тех важных функций, которые принадлежат ему в промышленности, биологии и медицине. [4]
Элементарный азот с большим трудом вступает в реакции обмена. [5]
Элементарный азот представлен в настоящем Справочнике наиболее полно. Таблицы термодинамических свойств N, N, N2, Nt и Ns полностью охватывают все существенные компоненты, которые могут быть образованы азотом при температурах до 20 000 К. Имеются масс-спектрометрические данные [ 2311, 3582, 3583, 4070а ], свидетельствующие о существовании иона NJ, однако нет оснований предполагать, что четырехатомный азот будет стабильным даже при не слишком высоких температурах. [6]
Элементарный азот встречается в природе; он составляет 78 % атмосферы по объему. [7]
Количественно элементарный азот в газовом анализе почти всегда определяют как остаток вместе с редкими газами после поглощения сопутствующих газов различными реагентами и сожжения горючих газов. При определении редких газов азот связывают металлич. [8]
Источником элементарного азота является только атмосферный воздух, запасы которого неисчерпаемы. [9]
Однако в элементарном азоте ( в) р-орбитали взаимно притягиваются, что дополнительно стабилизирует связь между атомами. Вследствие этого химические реакции гидразина ( а), приводящие к азоту ( б), протекают легко. Высокая устойчивость элементарного азота оказывает большое влияние на ход реакций, затрагивающих связь азот - азот. Поскольку азот - вещество со столь низкой энергией, его образование в реакции почти всегда приводит к уменьшению свободной энергии реакционной системы. Важно также отметить, что газообразный азот уже в момент образования покидает сферу реакции. Таким образом, равновесие в реакции с образованием элементарного азота невозможно, и вследствие этого исходное соединение можно полностью превратить в конечные продукты. [10]
 |
Функциональная схема производства аммиака. [11] |
Вместо подсистемы получения элементарного азота стоит знак вопроса. При дальнейшем рассмотрении указанных подсистем способ выделения азота из воздуха будет обоснован. [12]
Окисление аммиака до элементарного азота, глубокое окисление метанола до С02, наличие побочных реакций при окислении нафталина и в процессе окислительного аммонолиза пропилена предъявляют довольно жесткие требования к технологическому режиму процесса. Все перечисленные факторы и обусловливают температурный режим окислительных процессов. Очевидно, для экзотермических процессов, протекающих вблизи термодинамического равновесия ( окисление S02, HC1 и др.), надо добиваться понижения температуры с увеличением степени превращения. Для процессов во внеш-недиффузионной области ( например, окисление СН3ОН) желателен режим, близкий к изотермическому, особенно для избирательного катализа, при котором отклонение температуры на 10 - 20 град от заданной ( например, при синтезе высших спиртов) приводит к резкому возрастанию скорости побочных реакций или к снижению скорости основной. Очень часто термостойкость продуктов реакции диктует условия температурного режима. [13]
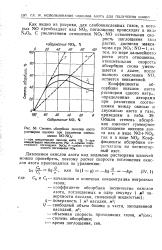 |
Степень абсорбции окислов азота раствором щелочи при различном соотношении NO. NO2. [14] |
Коэффициенты абсорбции пересчитаны на элементарный азот. [15]
Страницы: 1 2 3 4