Трехфтористый азот
Cтраница 2
Фтор, фтористый кислород OF2, трехфтористый хлор C1F3, перхлоралфторид FC1O3, трехфтористый азот NF3 могут быть использованы в качестве окислителей в ракетном топливе. [16]
Помимо него, в результате разрыва азот-углеродной связи образуется перфторэтиловый эфир, а также некоторое количество трехфтористого азота. [17]
Источником фтора могут служить следующие реагенты: хла-дон-14 ( CF4), хладон-116 ( C2F6), трехфтористый азот ( NF3), четырех-фтористый кремний ( SiF4) и другие соединения фтора. Наиболее предпочтительны соединения, в которых уже существуют прочные связи Si-F, чтобы уменьшить концентрацию несвязанного фтора и радикалов CF в пленках, приводящие к их термической нестабильности. Теоретически при большой концентрации фтора в пленках ФТСС можно получить значение k 3 0, однако практически при этом из-за высокой летучести частиц SiF2O пленки ФТСС становятся нестабильными при повышенных температурах. [18]
На основании этих данных делается заключение, что кислород и фтор являются далеко не лучшими окислителями; лучшим окислителем, повидимому, является моноокись фтора, за нею следуют фтор, трехфтористый азот, озон и кислород. [19]
Наряду с усовершенствованием давно применяемых в промышленности процессов электросинтеза неорганических соединений в последние годы разработаны многочисленные новые процессы, например синтез окиси фтора, фтористого сульфурила, пятифтористого хлора, гекса-фторида серы, трехфтористого азота. Известное внимание уделяется электросинтезу таких ценных продуктов, как озон и гидразин. [20]
Естественно, что по своим свойствам NF3 резко отличается от взрывчатого хлористого азота и от фтористого кислорода. Трехфтористый азот не реагирует с водой или растворами щелочей, хотя эти процессы сильно экзотермичны. Гидролиз его паром воды протекает медленно. Смеси NF3 с Н2, H2S, СН4 и СО воспламеняются только при нагревании; в таких же условиях реагируют щелЪчные и щелочноземельные металлы, олово, медь и ртуть. [21]
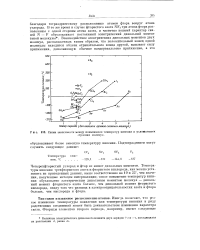 |
Схема зависимости между повышением температур кипения и усложнением. [22] |
Четырехфтористый углерод и фтор не имеют дипольных моментов. Температуры кипения трехфтористого азота и фтористого кислорода, как можно установить из приведенных данных, выше соответственно на 19 и 22, чем значения, полученные методом интерполяции; такое повышение температур кипения обусловлено электрическим дипольным моментом молекул - дипольный момент фтористого азота больше, чем дипольный момент фтористого кислорода, ввиду того что разница в электроотрицательностях азота и фтора больше, чем кислорода и фтора. [23]
Трифторацетонитрил фторируется трехфтористым азотом 18 при 520 С в присутствии фторида цезия в качестве катализатора до перфторированных метиламина, диметиламина, перфторазапропена и цианурфторида. [24]
Первый этап увенчался синтезом трехфтористого азота, который был получен Руффом в 1928 г., в Германии, при электролизе расплава бифторида аммония. В 1947 г. Бауэр3 сообщил о результатах проведенной там же работы по изучению электронной дифракции дифтордиазина, которые указывали на существование двух изомерных форм этого соединения, вероятно цис - и транс-изомеров. Этот период, по-видимому, продолжается и в настоящее время. [25]
Азот непосредственно не реагирует со фтором даже при высокой температуре и может быть использован как инертный разбавитель при реакциях фтора в газовой фазе. Однако электролизом фтористого аммония получается вполне устойчивый трехфтористый азот NF3 с положительно заряженным атомом азота; в противоположность этому треххлористый азот представляет собой взрывчатое соединение с отрицательно заряженным атомом азота. [26]
Следует отметить, что ее фторирование протекает иначе, чем бромирование. Продуктами деструктивного фторирования являются в основном трехфтористый азот и тетрафторметан, а также небольшие количества трифтор-метана и трифторметилдифторамина. [27]
Эти соединения термически также очень устойчивы и, насколько можно судить по довольно скудным химическим исследованиям, сделанным к настоящему времени, являются очень инертными химически. По-видимому, они в этом отношении очень похожи на трехфтористый азот. Они не показывают даже и следов характерных основных свойств, присущих аналогичным аминам. [28]
Наиболее эффективным жидким окислителем является моноокись фтора. За ней по порядку следуют жидкие: фтор, трехфтористый азот, озон и смесь жидкого озона и кислорода. [29]
Известны горелки для резания металла, в которых используется фтор и фторхлориды. В настоящее время сконструирована горелка, работающая па смеси трехфтористого азота и водорода. [30]
Страницы: 1 2 3 4