Акваионы
Cтраница 1
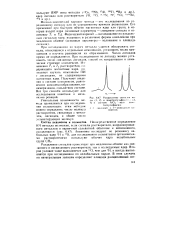 |
Расщепление сигналов воды ( /. 2 и диметилсу. чьфокси и ( J, 1 в системе А1С13 вод. димг. [1] |
Акваионы исследуют по резонансу лабильных ядер Н и 7О, для исследования сольватации органическими растворителями используют обычно ядра нелабильных групп СНП. [2]
На самом деле многие из них, в том числе акваионы Со2, окисляются лишь с большим трудом. Это свидетельствует о том, что избыточный электрон располагается на несвязывающей орбитали и его потеря не ведет к крупному выигрышу энергии. [3]
При рН менее 5 аммиачный комплекс распадается и цинк образует простые акваионы. Аммиакатные электролиты обладают хорошей рассеивающей способностью и пригодны для цинкования сложнорельефных деталей. [4]
Конечные комплексные ионы включают многочисленные ок-соионы и комплексные галогенидные ионы, акваионы в некоторых гидратах ( например, А1 ( Н20) 63), все конечные заряженные координационные комплексы, не говоря уже о самых простых ионах типа CN -, C22 -, С2 -, О22 -, и многие другие. Кристаллы, содержащие меньшие по размерам или более симметричные комплексные ионы, часто имеют структуры, подобные структурам соединений АтХя ( см., например, разд. [5]
Цирконий в различных аналитических условиях, в зависимости от состава и способа приготовления раствора, может присутствовать в виде ионов различного состава ( оксоионы, гидрооксоионы, акваионы и др.) и проявлять неодинаковую реакционную способность. [6]
Кинетическое маскирование основано на различии в скоростях образования комплексонатов в определенных условиях. Например, акваионы хрома ( III), алюминия, никеля ( II) кинетически инертны. [7]
В отличие от Be ( II) аквакомплексы Li ( I) менее устойчивы. В имеющихся кристаллогидратах лития отдельные акваионы не обнаружены. [8]
Наименее исследованы структуры жидкостей и аморфных твердых веществ. Здесь возникают значительные трудности как в эксперименте, так и в интерпретации рентгенограмм. Поэтому исследованы лишь простейшие системы, в основном акваионы в водных растворах. [9]
Сетка линий делит диаграмму & - рН для системы Fe - H2O на зоны преобладания определенных компонентов и фаз. Таким образом, ниже ломаной линии / - 2 - 3 располагается область, охватывающая те значения потенциалов и рН, при которых железо существует в металлическом состоянии и является устойчивым. Эта область может быть названа областью термодинамической коррозионной устойчивости железа или областью его иммунитета. Выше ломаной линии 10 - 4 - 7 - 2 - 8 - 6 располагается область преобладания твердых соединений железа, которые могут защищать его от дальнейшего разрушения. Эта область является, таким образом, вероятной областью пассивности железа. На диаграмме можно выделить также две области потенциалов и рН, внутри которых железо должно подвергаться коррозии. В этой области преобладают акваионы двухвалентного или трехвалентного ( выше пунктирной линии 9) железа. Другая область коррозии заключена между ломаной линией 3 - 8 - 6 и правой осью координат. Кроме того, они дают известные указания на то, за счет какой реакции - выделения водорода или восстановления кислорода - идет растворение металла. Действительно, если выбранная точка А находится между линиями / и Ь, то растворение металла с образованием ионов Fe2 может протекать как за счет реакции выделения водорода, так и за счет реакции восстановления кислорода. [10]
Сетка линий делит диаграмму S - рН для системы Рс-ГЬО на зоны преобладания определенных компонентов и фаз. Гак, линия / разделяет зоны преобладания металлического железа ( ниже липни /) и его гидратпровапных двухвалентных ионов ( иыше линии /), липни 2 - : оны преобладания металлического железа и гндроксида Fe ( II), а линия 3 - зспы преобладания металлического железа и ионов FlFeOjT. Таким образом, ниже ломаной линии / - 2 - 3 располагается область, охватывающая те значения потенциалов и рН, при которых железо существует в металлическом состоянии и является устойчивым. Эта область может быть названа областью термодинами1 еской коррозионной устойчивости железа или областью его иммунитета. Выше ломаной линии 10 - 4 - 7 - 2 - 8 - б располагается область преобладания твердых соединений железа, которые могут защищать его от дальнейшего разрушения. Эта область является, таким образом, вероятной областью пассивности железа. На диаграмме можно выделить также две области потенциалов и рН, внутри которых железо должно подвергаться коррозии. В этой области преобладают акваионы двухвалентного или трехвалентного ( выше пунктирной линии 9) железа. Другая область коррозии заключена между ломаной линией 3 - 8 - 6 и правой осью координат. Кроме того, они дают известные указания на то, за счет какой реакции - выделения водорода или восстановления кислорода - идет растворение металла. Действительно, если выбранная точка А находится между линиями / и /, то растворение металла с образованием ионов Fe24 может протекать как за счет реакции выделения водорода, так и за счет реакции восстановления кислорода. [11]
Страницы: 1