Deae-сефадекс
Cтраница 1
Бензоилированный вариант DEAE-сефадекса А-25, называемый BD-сефадекс, применяется в хроматографии рибонуклеиновых кислот. Его емкость для малых ионов равна 2 4 мэкв. Степень бензоилирования соответствует примерно 5 мэкв. И бензоильные, и диэтиламиноэтильные группы непосредственно связаны с глкжозными остатками сшитой полидекстрановой матрицы. [1]
К наиболее часто применяемым гидрофильным гелям относятся DEAE-сефадекс А-25 в сочетании с градиентным элюиро-ванием раствором хлорида натрия и сефадекс G-25 с применением в качестве элюента дистиллированной воды. [2]
Для разделения нуклеотидов широкое применение находят DEAE-целлюлоза и DEAE-сефадекс. [3]
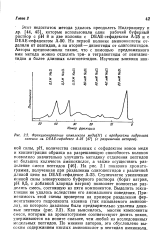 |
Фракционирование комплексов меди ( П с продуктами гидролиза казеина на DEAE-сефадексе А-25 ( с разрешения авторов. [4] |
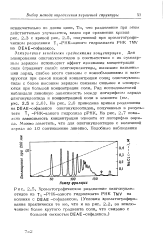
На рис. 2.1 показана хромато-грамма, полученная при разделении олигопептидов с различной длиной цепи на DEAE-сефадексе А-25. Ступенчатое увеличение ионной силы элюирующего буферного раствора ( борат натрия, рН 8 5, с добавкой хлорида натрия) позволяет полностью разделить смесь, состоящую из пяти компонентов. Выделить гекса-глицин не удалось вследствие его аномального поведения. Как выяснилось, многие компоненты смеси, которым на хроматограмме соответствуют десять пиков, удерживаются на ионите сильнее, чем любой из исследованных модельных пептидов. По мнению авторов, это обусловлено высоким содержанием кислых аминокислот в пептидах аминозола. [5]
Другой метод основан на реадсорбции олигонуклеотидов, выделенных колоночной хроматографией, на свежей порции DEAE-целлюлозы или DEAE-сефадекса. Раствор олигонуклеотида разбавляют в пять раз водой и вводят в колонку, размер которой обычно не превышает половины размера колонки, использовавшейся на предыдущем этапе очистки для фракционирования по длине цепи. Для тетрамеров достаточно концентрации ТЕАВ менее 1 М, а более короткие олигонуклеотиды можно элюировать еще более низкими концентрациями. В некоторых случаях для этих же целей используют NH4HC03i однако ТЕАВ легче удалить. [6]
Бремер и др. [350] для крупномасштабного выделения ганглиозидов рекомендуют методику, в основе которой лежит хроматография на DEAE-сефадексе А-25. Для маломасштабного выделения ганглиозидов из плазмы рекомендуется следующая процедура: сначала проводят распределение веществ между двумя фазами смесью хлороформ - метанол ( 1: 1 - 2: 1) и водой, а затем - ВЭЖХ на обращенной фазе с использованием патронов сеп-пак Cis ( Waters Associates, США); ганглиозиды элюируют метанолом. Ивамори и Нагаи [359] и Фридман и др. [351] сравнили различные анионооб-менники на основе сефадекса по их способности разделять ганглиозиды. Наилучшим оказался DEAE-сферозил; на нем удавалось провести хорошее разделение моно -, ди -, три -, тетра - и пентасиалоганглиозидов. [7]
При разделении белков ионообменной хроматографией [52] применяют прежде всего ионообменные смолы на полисахаридной основе, например аниониты DEAE-целлюлозу ( диэтиламиноэтилцеллюлозу) или DEAE-сефадекс и катиониты КМ-цел-люлозу ( карбоксиметилцеллюлозу) или КМ-сефадекс, в которых функциональные ионообменные группы связаны с гидроксильными группами моиосахаридных остатков. Гидрофильная основа иоиообменников не приводит х денатурации белков. При концентрационном градиенте ионизованные белки разделяются в результате взаимодействия с ионами соли, в случае градиента рН разделение вызвано изменением электрических зарядов белков. Ионообменная хроматография предложена в 1956 г. Петерсоном и Соберем. На рис. 3 - 7 приведена диаграмма элю-ирования смеси различных гемоглобинов. [9]
То, что разделение при этом действительно улучшается, видно при сравнении кривой рис. 2.3 с кривой рис. 2.5, полученной при хроматографи-ческом разделении Т1 - РНК-азного гидролизата РНК TMV на DEAE-сефадексе. [11]
Ионообменную хроматографию белков [20] выполняют на ионообменниках, имеющих гидрофильную матрицу, например на целлюлозе и декстране. Анионообменники, особенно DEAE-целлюлозу и DEAE-сефадекс, используют чаще, чем катионооб-менники типа СМ-целлюлозы. Ионообменники на основе целлюлозы имеют открытую сетчатую структуру с ионизованными центрами, легкодоступными для белков. Число ионных связей, образующихся между обменником и белком, зависит не только рт используемого материала, но также в большой степени от рН и ионной силы буфера. Эти ионные пары постоянно диссоциируют и образуются вновь, так как ионы элюента конкурируют за центры обмена. Обменники, пригодные для фракционирования белков, имеют низкую плотность зарядов, поэтому число ионных связей между ионитом и отдельными молекулами белка не столь велико, чтобы вообще воспрепятствовать продвижению последних вдоль колонки. Хотя ионные связи постоянно диссоциируют и образуются вновь, в начале хроматографирования белок связывается с ионообменником и не элюируется с колонки. Однако когда концентрация небольших конкурирующих ионов буфера возрастает до такого уровня, что все связи одновременно разрываются, белок начинает двигаться вниз по колонке. Если в процессе разделения используют градиент ионной силы, белок, перемещающийся в стартовой зоне медленнее, чем буфер, элюируется им при увеличении концентрации ионов. Таким образом, элюирующая способность буферного раствора постоянно увеличивается и макромолекула перемещается все быстрее и быстрее. Скорость ее перемещения становится сравнимой со скоростью движения жидкости, когда в элюенте достигается такая концентрация соли, которая эффективно препятствует взаимодействию молекулы белка с обменником. Важное значение в каждом отдельном случае имеет профиль градиента: чтобы увеличить разрешение пиков в определенных участках хромато-граммы, используемый градиент должен быть сравнительно пологим, но в то же время достаточно крутым в других участках, чтобы избежать уширения пиков. [12]
Образовавшиеся гидразоны соединяются путем азосочетания с дианизидином и образуют красители. Далее производится хроматография всей суммарной РРНК на DEAE-сефадексе. Только та РРНК, которая была защищена от окисления благодаря прикрепленной к ней аминокислоте, слабо захватывается сорбентом и отделяется препаративно от всех остальных. [13]
Существенное усовершенствование в методику хроматографии олигонуклеотидов ввел Тенер, предложивший включить в состав элюента 7 М мочевину. Это позволило подавить агрегацию крупных молекул олигонуклеотидов и их неспецифическую сорбцию ( за счет водородных связей) на полисахаридных матрицах DEAE-целлюлозе и DEAE-сефадексе, которые благодаря этому удалось успешно использовать для фракционирования олигонуклеотидов. При нейтральном рН в присутствии 7 М мочевины элюцией линейным градиентом концентрации NaCl ( 0 - 0 3 М) Тенер успешно разделял олигонуклеотиды по длине, а в кислой области рН, используя вклад положительного заряда оснований, олигонуклеотиды одинаковой длины - по составу. При рН 4 - 4 4 разделение шло главным образом по содержанию остатков цитозина и аденина ( они приобретают заметный заряд), а при рН 2 7 - по содержанию урацила, который остается при этом незаряженным. [14]
Стартовый буфер, используемый обычно для хроматографии на DEAE-целлюлозе, представляет собой 0 01 М трис ( рН 7 5 - 8) в 7М мочевине. Различие в стартовых буферах и крутизна градиента связаны с тем, что ионообменная емкость DEА Е - целлюлозы обычно составляет V, емкости DEAE-сефадекса. [15]
Страницы: 1 2