Активация - химическая реакция
Cтраница 2
Это значение гораздо ниже энергии активации химической реакции и, по-видимому, не имеет отношения к химическим процессам. [16]
 |
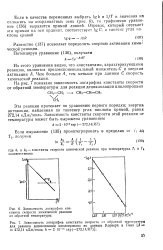
Зависимость константы.| Энергетический барьер химической реакции. [17] |
Этот избыток представляет собой энергию активации химической реакции. Из рис. VIII-2 следует, что энергия активации не связана определенным образом с тепловым эффектом реакции. [18]
Итак, катализаторы снижают энергию активации химических реакций. Это значит, что если та или иная химическая реакция требует для своего течения значительного притока энергии извне ( например, в форме тепла), то для осуществления этой же реакции при наличии катализатора внешней энергии потребуется значительно меньше. [19]
 |
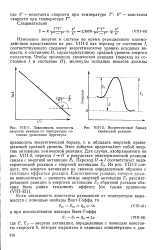
Зависимость константы скорости реакции от температуры согласно уравнению Аррениуса.| Энергетический барьер химической реакции. [20] |
Этот избыток представляет собой энергию активации химической реакции. Для случая, изображенного на рис. VIII-2, переход / - / / в результате экзотермической реакции связан с энергией активации Ег. Из рис. VIII-2 следует, что энергия активации не связана определенным образом с тепловым эффектом реакции. [21]
 |
Реактор идеального смешения. [22] |
Однако, как правило, энергия активации химической реакции значительно больше энергии активации процесса диффузии. Поэтому с ростом температуры скорость реакции растет быстрее, чем скорость диффузии, и реакция переходит в диффузионную область. [23]
Аналогичные соотношения получаются и для энергии активации химической реакции на поверхности, которая должна иметь наименьшее значение на энергетически богатых участках поверхности и наибольшее - в противоположном случае. [24]
Ускоряющее действие катализаторов состоит в понижении энергии активации химической реакции в результате изменения реакционного пути с участием катализатора или вследствие осуществления реакции по цепному механизму при инициирующем действии катализатора ( инициатора) ( см. гл. [25]
На основании опыта установлено, что энергия активации химических реакций, протекающих с хорошо измеряемой средней скоростью, вычисленная по формуле (1.8), составляет 15 - 30 ккал / моль. Реакции, нуждающиеся в меньшей энергии активации, идут так быстро, а требующие большей энергии активации - так медленно, что их скорости могут быть измерены только специальными приборами. [26]
Равенство ( 137) позволяет определить энергию активации химической реакции. [28]
Сущность ускоряющего действия катализаторов заключается в понижении энергии активации химической реакции или же в протекании реакции по цепному механизму с участием катализаторов. [29]
Однако в этом случае Е значительно меньше энергии активации химических реакций и не превышает 4 - 8 кдж / моль. Следовательно, при возрастании температуры скорость диффузии повышается значительно медленнее, чем скорость химической реакции. В области, где процесс лимитирует диффузия ( рис. 65 - область /), температура практически не влияет на скорость реакции, и наоборот, в области / / / только увеличение температуры приводит к росту скорости процесса. [30]
Страницы: 1 2 3 4 5