Активность - закись - железо
Cтраница 1
 |
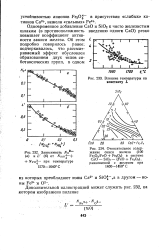
Упругость диссоциации окис. [1] |
Активность закиси железа меняется в зависимости от состава шлака. Максимальная активность закиси железа в системе RO - SiO2 - FeO оказывается при составе шлака, отвечающем ортосили-кату ( CaO MgO) SiO2, а при повышении содержания в шлаке кремнезема или извести активность закиси падает. [2]
 |
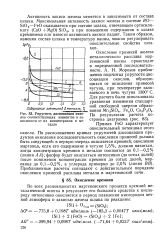
Зависимость логарифма константы. [3] |
Результаты расчетов активности закиси железа ai хорошо согласуются с экспериментальными ее значениями для шлаков разного состава с различной основностью. [4]
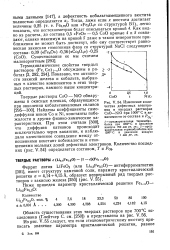 |
Изменение количества дефектных электронов в твердых растворах СоО - NiO при 1000 С в зависимости от состава и POj. [5] |
Показано, что активности закисей железа и кобальта, выбранных я качестве компонентов в этих твердых растворах, намного выше концентраций. [6]
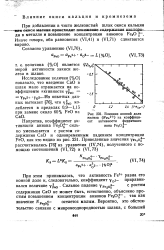 |
Влияние ионной доли железа ( ре2 на коэффициент активности ферритного. [7] |
О ] является мерой активности закиси железа в шлаке. [8]
Таким образом, чтобы найти активность закиси железа в шлаке любого состава, следует определить концентрацию кислорода в металле, находящемся в равновесии с этим шлаком. Если же арео известна как функция состава шлака, то можно вычислить концентрацию кислорода в железе под шлаком любого состава. [9]
Рассмотрим, например, связь между растворимостью кислорода в жидком железе [ О ] и активностью закиси железа в шлаке. [10]
Одновременное добавление СаО и S1O2 к чисто железистым шлакам ( в противоположность введению одного СаО) резко повышает коэффициент активности закиси железа. [12]
 |
Схематическое распределение концентраций ионов железа и кислорода и активность закиси железа по высоте слоя шлака. [13] |
На рис. 7 показано распределение концентрации 0 - - и Fe и активности FeO вблизи поверхности раздела металл - шлак. Активность закиси железа проходит через максимум на определенном расстоянии от поверхности раздела. [14]
Полученные данные об окислении ниобия, растворенного в железе, показывают, что этот элемент практически полностью переходит из металла в окислительный шлак. Установленная количественная зависимость показателя распределения ниобия от температуры относится к случаю, когда активность закиси железа в шлаке равна единице. Это позволяет подойти к расчету равновесия реакции окисления ниобия в случае реальных шлаков и оценить возможные потери ниобия при введении его лигатуры. [15]
Страницы: 1 2