Активность - ион - металл
Cтраница 1
Активность ионов металлов в реакциях, катализируемых кислотой, проявляется оч ш сильно. Так, реакции, которые катализируются ионами водорода или другими кислотами, обычно также катализируются ионами металлов, которые сами являются кислотами Льюиса. В действительности даже те реакции, которые катализируются только водородными ионами ( аи исключением таких специфичных катализаторов, как уксусная кислота), будут катализироваться ионами металлов. [1]
Активность ионов металла можно значительно уменьшить, связав их в прочные комплексы. Если константа нестойкости комплексного иона более благородного металла меньше, то потенциалы разряда сближаются. Благодаря этому в цианистых растворах удается соосадить медь и цинк, сер ебро и кадмий, медь и никель, имеющие в растворах простых солей разницу потенциалов разряда порядка 0 6 - 1 0 в. Кроме изменения активности ионов при комплексообразовании, изменяется также поляризация металлов. Как правило, из комплексных ионов металлы выделяются с более высокой поляризацией. [2]
Активность ионов металла незначительно изменяется с температурой, поэтому изменение логарифма активности с температурой в не очень большом температурном интервале можно считать ис-чезающе малым. [3]
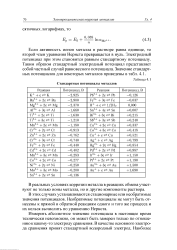 |
Стандартные потенциалы металлов. [4] |
Если активность ионов металла в растворе равна единице, то второй член уравнения Нернста превращается в нуль. Электродный потенциал при этом становится равным стандартному потенциалу. Таким образом стандартный электродный потенциал представляет собой частный случай равновесного потенциала. [5]
Если активность ионов металла в электролите постоянна, а активность анионов изменяется, то наблюдается изменение электродного потенциала е и одновременное изменение состава вещества покрывающего слоя. [6]
Когда активность ионов металла в растворе равна единице второй член уравнения Нернста превращается в нуль. Электродный потенциал при этом становится равным стандартному потенциалу. Таким образом, стандартный электродный потенциал представляет собой частный случай равновесного потенциала. [7]
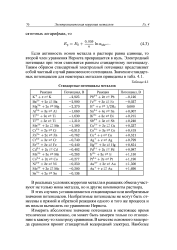 |
Стандартные потенциалы металлов. [8] |
Если активность ионов металла в растворе равна единице, то второй член уравнения Нернста превращается в нуль. Электродный потенциал при этом становится равным стандартному потенциалу. Таким образом стандартный электродный потенциал представляет собой частный случай равновесного потенциала. [9]
Когда активность ионов металла в растворе равна единице второй член уравнения Нернста превращается в нуль. Электродный потенциал при этом становится равным стандартному потенциалу. Таким образом, стандартный электродный потенциал представляет собой частный случай равновесного потенциала. [10]
Для активности ионов металла, равной единице, потенциал электрода имеет определенную величину П, которая называется стандартным или нормальным потенциалом электрода металл - ион металла. [11]
Когда активность ионов металла в растворе равна единице ( 1 г-ион / л), Е ЕО - Величина Е0 называется нормальным ( стандартным) потенциалом электрода. [12]
 |
Стандартные потенциалы металлов. [13] |
Если активность ионов металла в растворе равна единице, то второй член уравнения Нернста превращается в нуль. Электродный потенциал при этом становится равным стандартному потенциалу. Таким образом стандартный электродный потенциал представляет собой частный случай равновесного потенциала. [14]
Коэффициенты активности ионов металла в уравнениях ( VIII, 323 и VIII, 324) можно считать одинаковыми, так как в растворе имеется избыток индифферентного электролита. При этом общая концентрация ионов вблизи электрода при протекании тока практически не изменяется и коэффициенты активности в соответствии с правилом ионной силы будут постоянными. [15]
Страницы: 1 2 3 4