Активность - окисный катализатор
Cтраница 1
Активность окисных катализаторов в реакциях углеводородов связывается обычно с кислотными свойствами их поверхности. [1]
Активность окисных катализаторов щелочноземельной группы значительно ниже. Превращение протекает по другому механизму. В отсутствие катализатора основными продуктами реакции являются низкомолекулярные насыщенные и ненасыщенные углеводороды, свободный углерод и водород. [2]
 |
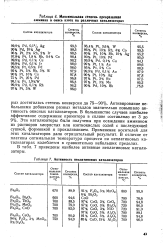
Сравнительные характеристики катализаторов, при полимеризации этилена. [3] |
Для повышения активности окисных катализаторов их предварительно восстанавливают ( кроме хромовых) и тогда их действие подобно действию восстановленной поверхности металлгалогенида. [4]
Проведено сравнение активности различных окисных катализаторов для реакций окислительных превращений углеводородов. Сделано предположение, что лимитирующей стадией реакции является образование на поверхности контактов кислород-углеводородных комплексов. Показана роль коллективных электронных свойств твердого тела на активность и селективность окислительных катализаторов. Рассмотрено действие добавок на простые и сложные окисные катализаторы. [5]
Большое влияние на активность окисных катализаторов имеет предварительная обработка и активация их. Сущность этого про цесса заключается в следующем. [6]
Фактором, определяющим активность окисных катализаторов в реакции окисления аммиака, как и в реакциях окисления водорода и окиси углерода, является подвижность их поверхностного кислорода. [7]
Неймана о зависимости активности окисного катализатора от давления кислорода, повышения активности следует ожидать в том случае, если при одинаковых температурах давление кислорода смешанного катализатора больше, чем давление его компонентов в отдельности. Привести доказательство этому пока затруднительно. [8]
Проведено сравнительное изучение активности твердых окисных катализаторов для полимеризации этилена, которая оценивалась по выходу полимера на единицу веса катализатора. Показано, что в той или иной мере активны окислы металлов групп VA, VIA, VIII, причем резкий максимум наблюдается у Мо. Наиболее активным носителем является А12Оа, наименее - активированный уголь. [9]
Стоун считает, что активность окисных катализаторов определяется полупроводниковыми свойствами. Все это говорит о том, что катализ на окислах представляет собой явление сложное и одних электронных или полупроводниковых представлений для его понимания недостаточно. [10]
Существует ряд добавок, повышающих активность окисных катализаторов: алюмогидриты, боргидриды, карбиды щелочных и щелочноземельных металлов. [11]
 |
Активность неплатиновых катализаторов. [12] |
Активирование небольшими добавками разных металлов значительно повышало активность окисных катализаторов. Эти катализаторы были получены при осаждении аммиаком из растворов хлористых или азотнокислых солей с последующей сушкой, формовкой и прокаливанием. [13]
Полученные результаты позволили предположить, что спад активности окисных катализаторов с температурой связан с тем, что их активные центры не обладают при низких температурах достаточной энергией для осуществления реакции. В том случае, когда катализатор имеет более высокую начальную температуру, появляется возможность возникновения на нем процесса, который в дальнейшем может поддерживаться вследствие высокой экзотермичности реакции. [14]
Эти выводы о влиянии прочности связи металл-кислород на активность окисного катализатора качественно подтверждаются опытами по частичному восстановлению поверхности при последовательном импульсном вводе проб бутена при отсутствии в газовой фазе кислорода. При этом должна расти величина Qu. В результате увеличения Q0 катализатор должен становиться менее активным в отношении реакции глубокого окисления. Согласно работам [53, 28], восстановление поверхности в результате протекания реакции окислительного дегидрирования сильнее всего уменьшает скорость глубокого окисления. Скорость реакций образования кислородсодержащих соединений уменьшается не так значительно. На реакции окислительного дегидрирования и изомеризации восстановление поверхности оказывает лишь слабое влияние. Это уменьшает убедительность указанной корреляции. Но ее самая слабая сторона - резкая разнородность сравниваемых систем. Действительно, сопоставляются окислы типа МеО, Ме203, Ме02, образованные как переходными металлами Сг, Fe, Ni, Mo, так и непереходными Zn, Sn, Bi. Они образуют также мало похожие промежуточные формы. Поэтому, если искать корреляцию термохимических и термодинамических характеристик окислов с их каталитическими свойствами, то в основу следовало бы скорее брать дифференциальные теплоты и свободные энергии частичного восстановления в условиях катализа каждой конкретной оксидной системы. Несмотря на то что очень высокие Q0 исключают катализ, а очень малые могут быть невыгодными, более вероятно все же, что не только селективность, но и активность при глубоком окислении в первую очередь определяется кинетическими, а не термохимическими величинами. Поэтому нет оснований искать далеко идущие корреляции между термохимическими свойствами окислов и их каталитической активностью. [15]
Страницы: 1 2 3