Активность - раствор - электролит
Cтраница 1
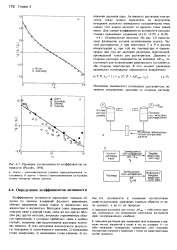 |
Проверка согласованности коэффициентов активности ( Редлих, 1976.| Активности и изменение коллигативных свойств растворов, зависящих главным образом от числа молекул, а не от их природы. [1] |
Активность растворов электролитов также можно определить по результатам измерения мольного эквивалента гальванических ячеек, однако этот вопрос выходит за пределы темы данной книги. [2]
Коэффициенты активности растворов электролитов можно определять методами, которые применимы к растворам неэлектролитов. [3]
Своеобразную логарифмическую величину представляет так называемый водородный показатель рН, характеризующий активность растворов электролитов. Последняя зависит от концентрации ионов в растворе. Однако эта зависимость не вполне однозначна из-за взаимодействия между ионами. Поэтому характеристикой активности концентрация может служить лишь в сильно разбавленных растворах. При больших значениях концентрации вводится понятие эквивалентной концентрации, представляющей собой произведение истинной концентрации на коэффициент активности, меньший единицы. Поскольку как истинная, так и эквивалентная концентрация ионов может изменяться в весьма широких пределах, пользуются логарифмической шкалой. [4]
Своеобразную логарифмическую величину представляет так называемый водородный показатель рН, характеризующий активность растворов электролитов. Последняя зависит от концентрации ионов в растворе. Однако эта зависимость не вполне однозначна из-за взаимодействия между ионами. Поэтому характеристикой активности концентрация может служить лишь в сильно разбавленных растворах. При больших значениях концентрации вводится понятие эквивалентной концентрации, представляющей собой произведение истинной концентрации на коэффициент активности, меньший единицы. Поскольку как истинная, так и эквивалентная концентрации ионов могут изменяться в весьма широких пределах, пользуются логарифмической шкалой. [5]
Величину ионной силы обычно выражают через молярные концентрации. Аналогичным образом выражают и активность раствора электролита. В практических работах очень часто в качестве единиц концентрации используется моляльность. Это связано с тем, что взвешивание можно производить более точно, чем измерение объема, с одной стороны, а с другой - моляльность не зависит от температуры. [6]
Как растворитель серная кислота во многих отношениях напоминает воду, несмотря на разницу в их кислотности. Сравнение электропроводности, вязкости, плотности и активности растворов электролитов в серной кислоте и в воде помогает понять общие свойства электролитов. [7]
Эта поправка носит название фактора. Ван т - Г о ф ф а, обозначается буквой i и показывает, во сколько раз осмотическая активность раствора электролита больше осмотического давления эквимолекулярного раствора неэлектролита. [8]
Страницы: 1