Активность - соль
Cтраница 1
Активность соли в отношении Klebsiella pneumoniae равна 210 едмгии. Наконец, заслуживает внимания недавно предложенный метод анализа маннозидо-стрептомицина с помощью антрона1871, ранее уже рекомендованного для количественного определения углеводов. Оказалось, что антрон способен реагировать только с ман-нозидо-стрептомицином, но не со стрептомицином. [1]
Активность соли, насыщающей раствор, одинакова для всех насыщенных растворов этой соли при одной и той же температуре, независимо от химического состава этих растворов - от бинарного насыщенного раствора до смешанного раствора, насыщенного двумя солями. Активность соли при этом сохраняет постоянное значение, равное 7ге у8, где та - моляльность, a Y - коэффициент активности соответствующего электролита в бинарном насыщенном водном растворе. [2]
Активность солей железа зависит от структуры органических радикалов полисилоксана. [3]
Активность соли металла переменной валентности зависит прежде всего от природы катиона. [4]
Понятием активность соли в электрохимии обычно не пользуются. [5]
Рассчитать активность соли в водном растворе при концентрации 0 2866 кмоль / м3, если раствор его в бензоле остается идеальным до с 0 03 кмоль. [6]
 |
Влияние валентности аниона на сдвиг течки рН гид -, ратсобразования 0 5 н. FeSO, I M раствор. Г - КЖцГг - iLso.. 12 16 С, мл з - К3Р04 - 2 4. [7] |
С повышением активности соли в растворе всегда неизбежен переход от образования гидрата к образованию основной соли. При этом возможно изменение величин х и у (1.7), т.е. образование в зависимости от условий основных селей разного состава. [8]
При изменении коэффициентов активности высаливаемой соли в присутствии высаливателя, естественно, происходит и изменение ( в соответствующую сторону) коэффициентов распределения. [9]
Влияние неэлектролита на коэффициент активности соли обычно исследуется при сравнительно высокой концентрации соли, так что имеет место и взаимодействие между ионами самой соли. Этот вк лад в у следует учитывать особо. [10]
В выражение для / QTBJO активность соли не входит, так как последняя является фазой постоянного состава, и поэтому ее активность можно приравнять единице. Можно также сказать, что концентрация твердой соли постоянна и поэтому входит в константу равновесия. Произведение растворимости - понятие, приложимое только к насыщенным растворам. [11]
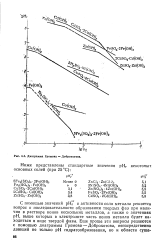 |
Диаграмма Громова - Доброхотова. [12] |
С помощью значений рНг и активности соли металла решается вопрос о последовательности образования твердых фаз при наличии в растворе ионов нескольких металлов, а также о значениях рН, выше которых в электролите часть ионов металла будет находиться в виде твердой фазы. [13]
 |
Сравнение кривых нотенциометрического титрования 0 01 N раствором соли ВаС12 чистого золя As2S3 ( 1 и золя As2S3 с добавкой 0 01 е хингидрона ( 2. [14] |
Эта формула не учитывает изменения активности вводимой соли в коллоидном растворе. Поэтому в начале титрования, когда катионы соли адсорбируются, ошибка бывает невелика, но она возрастает по мере прибавления электролита. [15]
Страницы: 1 2 3 4