Активность - спирт
Cтраница 1
Активность спиртов повышается с уменьшением прочности связи электрона в группе R. Так, например, вторичный бутиловый спирт не реагирует с 90 % - ной перекисью водорода в присутствии серной кислоты в стандартных условиях. В тех же самых условиях третичный бутиловый спирт и 1-фенилэтанол полностью реагируют в течение 5 час. Дифенилметанол несколько более активен, и, наконец, ксантгидрол алкилирует 30 % - ную перекись водорода в нейтральной среде. [1]
Активность спирта зависит как от положения ОН-группы, так и от наличия заместителей в молекуле. Но имеющиеся данные несистематичны и часто разноречивы. Во всяком случае твердо установлено, что первичные гидр-оксилы активнее вторичных. [2]
Определены коэффициенты активности спиртов, ацетатов, кетонов и хлорированных углеводородов в растворах эфиров фталевой кислоты. [3]
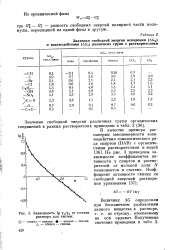 |
Зависимость lg 7 2 от состава раствора для систем. [4] |
На рис. 3 приведены зависимости коэффициентов активности Y спиртов и растворителей от мольной доли N компонентов в системе. [5]
 |
Свойства некоторых фенолов и нитрофенолов. [6] |
Физиологическая активность фенолов значительно выше, чем активность спиртов. Они являются более сильными инсектицидами, фунгицидами, бактерицидами и гербицидами. [7]
Скорость реакции зависит, в первую очередь, от активности спирта или фенола. Метанол реагирует при комнатной температуре, и замещение атомов хлора на метоксигруппы происходит полностью при условии удаления хлористого водорода путем продувания сухого воздуха. [8]
В области больших содержаний воды, при которых растворимость соли достаточно высока, присутствие соли в растворе заметно влияет на активность спирта и воды. [9]
В случае нитроспиртов, уже имеющих объемистые МОг-группы, вызывающие сильное стерическое блокирование гидроксилов, введение алкильных групп ( в случае вторичных и третичных спиртов) сказывается на активности спирта меньше. [10]
В случае нитроспиртов, уже имеющих объемистые Ы02 - группы, вызывающие сильное стерическое блокирование гидроксилов, введение алкильных групп ( в случае вторичных и третичных спиртов) сказывается на активности спирта меньше. [11]
Изучение реакции этерификации дикарбоновой кислоты нитроспиртами подтвердило данные, полученные при этерификации J - ( треметилсилил) пропионовой кислоты - с накоплением нитрогрупп в молекуле спирта в р-положении к гид-роксилу наблюдается уменьшение активности спиртов. [12]
Такая гипотеза становится еще более убедительной, если учесть, что Н. М. Барон и К. П. Мищенко [6] на основе изучения давления и состава пара над растворами NaBr в смеси Н20 - СН3ОН показали, что понижение активности спирта в растворителях с 29 и 50 мол. Аналогичный вывод получен при обработке соответствующих данных Батлера [7] для растворов LiCl в системе Н 0 - С. Это показывает, что в процессе первичной сольватации молекулы спирта не способны конкурировать с молекулами воды при образовании гидро-сольватных оболочек ионов и смешанные сольваты образуются только при дефиците воды. [13]
Такая гипотеза становится еще более убедительной, если учесть, что Н. М. Барон и К. П. Мищенко [279] на основе изучения давления и состава пара над растворами NaBr в смеси Н2О - СН3ОН показали, что понижение активности спирта в растворителях с 29 и 50 % ( мол. Аналогичный вывод получен [279] при обработке соответствующих данных Батлера [441] для растворов LiCl в системе Н2О - С2Н5ОН, причем отвечающая началу вхождения молекул спирта в гидратные сферы концентрация смещается в сторону большего содержания спирта, что совпадает с ГПГ для LiCl. Это показывает, что в процессе первичной сольватации молекулы спирта не способны конкурировать с молекулами воды при образовании гидро-сольватных оболочек ионов и смешанные сольваты образуются только при дефиците воды. [14]
Такая гипотеза становится еще более убедительной, если учесть, что Н. М. Барон и К. П. Мищенко [6] на основе изучения давления и состава пара над растворами ГчаВг в смеси Н20 - СН3ОН показали, что понижение активности спирта в растворителях с 29 и 50 мол. СН 3ОН начинается только после достижения границы полной гидратации NaBr. Аналогичный вывод получен при обработке соответствующих данных Батлера [7] для растворов LiCl в системе Н20 - С2Н6ОН, причем отвечающая началу вхождения молекул спирта в гидратные сферы концентрация смещается в сторону большего содержания спирта, что совпадает с ГПГ для LiCl. Это показывает, что в процессе первичной сольватации молекулы спирта не способны конкурировать с молекулами воды при образовании гидро-сольватных оболочек ионов и смешанные сольваты образуются только при дефиците воды. [15]
Страницы: 1 2