Активность - вода
Cтраница 3
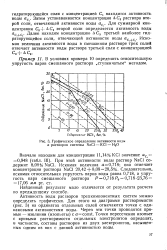 |
Графическое определение активности воды а растворов системы NaCl - - КС1 - Н2О. [31] |
Активность воды растворов трехкомпонентных систем можно определять графически. Для этого на диаграмме растворимости ( рис. 3) на ординатах отдельных солей отмечаются точки с одинаковыми активностями воды. Через эти точки проводятся прямые-изолинии ( изопьеты) с aconst. [32]
Поскольку активность воды уменьшается и концентрация ионов возрастает, гидратация ионов становится менее полной, а взаимодействие ионов с водой - 1 - менее существенным. Кроме того, происходит усадка ионита, в результате чего фаза ионита становится еще более концентрированной, а средний размер пор уменьшается. Это приводит к возрастанию роли ситового эффекта. [33]
Когда активность воды в таких растворах падает, по крайней мере одна из молекул воды, входящих в первичную гидратную оболочку катиона, замещается сульфогруппой ионита. В результате образуется прямая связь между сульфогруппой и катионом, приводящая к высоким коэффициентам распределения. Эти представления, по-видимому, могут быть распространены на катионы IV, V и VI групп; однако экспериментальные доказательства наличия или отсутствия таких связей катионов с сульфогруппами ионита не получены. [34]
Когда активность воды в экспериментальных условиях мало меняется, степень гидратации h остается постоянной, уменьшение активности соли во всех случаях одинаково, и его можно не учитывать в расчетах. Этим объясняется широко распространенное ( в общем случае неверное) мнение о том, что извлечение воды существенно не влияет на экстракцию аммониевыми солями и на их ассоциацию в неполярных разбавителях. [35]
Поскольку активность воды уменьшается и концентрация ионов возрастает, гидратация ионов становится менее полной, а взаимодействие ионов с водой - менее существенным. Кроме того, происходит усадка ионита, в результате чего фаза ионита становится еще более концентрированной, а средний размер пор уменьшается. Это приводит к возрастанию роли ситового эффекта. [36]
Когда активность воды в таких растворах падает, по крайней мере одна из молекул воды, входящих в первичную гидратную оболочку катиона, замещается сульфогруппой ионита. В результате образуется прямая связь между сульфогруппой и катионом, приводящая к высоким коэффициентам распределения. Эти представления, по-видимому, могут быть распространены на катионы IV, V и VI групп; однако экспериментальные доказательства наличия или отсутствия таких связей катионов с сульфогруппами ионита не получены. [37]
Когда активность воды ( давление пара, если это-фаза пара) растет, образуется слой толщиной в несколько молекул. Этот слой существенно отличается по структуре от объема воды, так что последний может сосуществовать в равновесии с пленкой при Р, становится возможной конечная величина краевого угла, что и наблюдается экспериментально. [38]
Изменяется активность воды и коэффициенты активности экстрагируемой соли. Поэтому, чем сильнее гидратируется катион, тем сильнее высаливание - конкуренция ЬЬО за экстрагируемый катион подавляется. [39]
Здесь активность воды, как обычно, не указана, поскольку она постоянна. [40]
Снижение активности воды отражается на растворимости солей, приводит к ухудшению смачивания поверхности частиц. Изменение свойств раствора после обработки не является однозначным и требует выяснения в каждом конкретном случае. [41]
Коэффициенты активности воды, приведенные в работе Пирса и Нелсона [38], вычислены неверно. [42]
Расчет активности воды по методу Эзрохи требует вычисления с. [43]
Значения активности воды в растворах NaHCOa вычисляются по более сложным формулам ( см. с. [44]
При этой активности воды раствор NaCl содержит 8 08 % NaCl. [45]
Страницы: 1 2 3 4