Активность - фенол
Cтраница 2
Исследование этой реакции с фенолами показало [46], что положение заместителя имеет решающее влияние на активность фенола. [16]
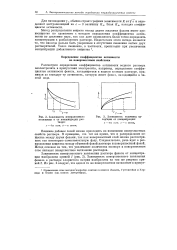 |
Зависимость поверхностного натяжения а от концентрации раствора.| Зависимость величины адсорбции от концентрации. [17] |
Рассмотрим определение коэффициентов активности водного раствора неэлектролита в присутствии электролита, например, определение коэффициентов активности фенола, находящегося в водном солевом растворе, принимая за стандарт ту активность, которую имеет фенол, находящийся в чистой воде. [18]
В соответствии с данными других авторов, полученными при изучении действия ингибиторов на процесс окисления газолина [107] и парафина [66], было найдено, что алкильные заместители повышают активность фенола. Замещение в лг-положе-нии менее эффективно, чем в о - и п-положениях. В соответствии с упомянутыми работами, проведенными на других субстратах, максимальная эффективность была получена с триза-мещенными ( 2, 4, 6) фенолами. [19]
В реакцию Пехмана могут вступать разнообразные фенолы и эфиры jB - кетокислот. При этом активность фенолов зависит от присутствия в ядре тех или иных заместителей; галогены и сильные электроноакцепторные заместители обычно затрудняют конденсацию. [20]
Характерно, что введение ОН-группы в пара-положение придает фенолу свойства антагониста ИУК. Если ОН-группа находится в мета - или орто-положе-нии, то активность фенола или ослабевает, или теряется. [21]
Новейшими лаковыми резолами можно считать пластифицированные и отверждающиеся фенольные смолы, в которых эластичность обеспечена введением в молекулу групп сложных или простых эфиров. В их образовании участвуют вводимые в нужном количестве метилольные группы ( образование фенолодиспиртов или метилендифенолтетраспиртов); это значительно снижает активность фенолов, и для подобных смол необходима горячая сушка. [22]
Наличие второй фенольной группы снижает активность приблизительно на 60 %; алкнлпирогаллолы и алкилфлороглюцины ( с тремя гидро-ксильными группами) еще менее активны. Токсические свойства фенолов ослабляются при гидрировании или этерификацин. Активность фенолов повышается с удвоением молекулы через посредство мегичеиовой, дикарбонильной группы, кислорода или серы. Напротив, связывание двух молекул фснота через - СО-или 5Ог - группу снижает активность. [23]
Фенольные соединения могут действовать и как эстрогены, регенерирующие нарушения половой деятельности у самок животных с удаленными яичниками. Эстрогенная активность связана со структурой этих фенолов, обычно п оксистильбенов. Этерификация гидроксильных групп может повысить активность фенолов. Точная зависимость между строением эстрогенов и их активностью неизвестна. Растительные эстрогены, например изофлавоны, обладают сравнительно невысокой активностью. Однако в определенных условиях она может оказаться достаточной для того, чтобы привести к нежелательным последствиям и снизить плодовитость при кормлении скота растениями с повышенным содержанием изофлавонов. [24]
Заместители в ж - и - положении к фенольной или аминной группе меняют прочность соответственно О - Н - или N - Н - связи и влияют на реакционную способность ингибитора. Коэффициент р имеет отрицательное значение, так как при наличии электродонорных заместителей ( алкильной, алкоксиль-ной, фенильной групп) активность ингибитора возрастает, а при наличии электроотрицательных - снижается. Объемные заместители в о-положении способствуют снижению активности фенола. [25]
Приведенная классификация фенолов составлена на основании данных упомянутых авторов. Характерно, ФО швдеййй ОН руп пы в w - полошение придает фенольному соединению свойства антагониста ИУК. Если ОН-группа находится в мета - или орто-положении, то активность фенола или ослабевает, или теряется. [26]
При этом мы получим прямую, параллельную оси концентраций. Это изменение / С происходит потому, что добавляемая соль связывает часть воды, водный слой становится более концентрированным по отношению к фенолу и больше фенола переходит в бензольный слой. В этом случае коэффициент активности фенола становится больше единицы. [27]
При этом получим прямую, параллельную оси концентраций. В этом случае коэффициент активности фенола становится больше единицы. [28]
При этом получим прямую, параллельную оси концентраций. Это изменение К происходит потому, что добавляемая соль связывает часть воды, водный слой становится более концентрированным по отношению к фенолу и больше фенола переходит в бензольный слой. В этом случае коэффициент активности фенола становится больше единицы. [29]
Мы видели, какое значение принадлежит ионным центрам при ориентации заместителей. При этом нередко взамен орто - и пара-нитрозамещенных получаются мета-нитропроизводные, При низких температурах в присутствии концентрированной кислоты нитруется не свободный амин, а его соль. Существенное значение принадлежит солеобразованию при реакции азосочетания. Как известно, азосочетание с аминами не идет в присутствии минеральной кислоты, ее обычно нейтрализуют ацетатом натрия. Фенолы сочетаются в слабо щелочном растворе, так как активность фенолята в качестве азосоставляющей выше активности фенола. [30]
Страницы: 1 2