Активность - хлорид-ион
Cтраница 1
Активность хлорид-ионов в клетках измеряют с помощью твердых микроэлектродов второго рода, покрывая кончик инертного металлического микроэлектрода мембранным материалом, например AgCl. Разработаны твердые микроэлектроды с мембраной из смеси Hg2Ch и Hg2S, которые применяются для определения ионов хлора в растительных тканях. [1]
Если активность хлорид-ионов равна 1, то правая часть уравнения пот. [2]
Реальные коэффициенты активности хлорид-ионов в водных растворах КС1 различной концентрации определены при 25 С в двух сериях экспериментов. [3]
Оценку коэффициента активности хлорид-иона обычно делают по уравнению Дебая - Хюккеля или приравнивают среднему ионному коэффициенту активности НС1 в водном растворе кислоты с такой же ионной силой, какую имеет буферный раствор. [4]
Он зависит только от активности хлорид-ионов в растворе. [5]
Установлено, что потенциал линейно зависит от активности хлорид-ионов в широком диапазоне. [6]
Потенциал каломельного электрода зависит от температуры и активности хлорид-ионов. [7]
Серебряную проволоку можно опустить непосредственно в анализируемый раствор если активность хлорид-ионов в нем остается постоянной. Если этого нет и если присутствие хлорид-ионов мешает определению, надо приготовить отдельный электрод сравнения и соединить его с электролизером солевым мостиком. [8]
Серебряную проволоку можно опустить непосредственно в анализируемый раствор, если активность хлорид-ионов в нем остается постоянной. Если этого нет и если присутствие хлорид-ионов мешает определению, надо приготовить отдельный электрод сравнения и соединить его с электролизером солевым мостиком. [9]
 |
Электрод сравнения. [10] |
Серебряную проволоку можно опустить непосредственно в анализируемый раствор, если активность хлорид-ионов в нем остается постоянной. [11]
В выражении (6.19) неизвестны только активность ионов водорода и коэффициент активности хлорид-ионов. Последний можно взять из справочников или рассчитать по уравнению Дебая-Хюккеля. [12]
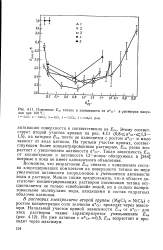 |
Изменение Е к титана в зависимости от а с - в растворах хлоридов при 100 С. [13] |
Возможно, что возрастание Е к связано с изменением состава хлорсодержащих комплексов на поверхности титана по мере увеличения активности хлорид-ионов и уменьшения активности воды в растворе. Можно также предположить, что в области достаточно концентрированных растворов пассивация титана осуществляется не только свободной водой, но и сильно поляризованными молекулами воды, входящими в состав гидратных оболочек катионов. [14]
Как видно из уравнений (1.10) и (1.11), обратимые потенциалы для этих пар являются функциями стандартных электродных потенциалов и активности хлорид-иона. [15]
Страницы: 1 2 3