Активность - хлорид-ион
Cтраница 2
Это означает, что в ряду LiCl - NaCl - КС1 - CsCl коэффициент активности катиона должен уменьшаться, а коэффициент активности хлорид-иона - возрастать. Как показывают рис. 4.1 и 4.2, этот вывод оправдывается только для катионов, тогда как для аниона зависимость обратна ожидаемой. Однако это не означает, что вклад взаимодействия между одинаковыми катионами ( которое можно назвать самовысаливанием катионов) в увеличение значений YM не возрастает в ряду CsCl - LiCl. Очевидно лишь, что существенную роль в изменении ионных коэффициентов активности играют факторы, не учитываемые в модели Швабе. В частности, к таким факторам относится структурная составляющая, связанная с влиянием ионов на структуру жидкой воды. [16]
Таким образом, скорость выделения кислорода на аноде должна в наибольшей степени зависеть от активности ионов водорода в растворе, уменьшаясь с возрастанием их активности. Снижению выделения кислорода должно способствовать возрастание активности хлорид-ионов в растворе. [17]
 |
Значения Y. ввод - компенсирующих напряжений. [18] |
Возможность определения коэффициентов активности ионов одного вида на основе измерения потенциалов электрокапиллярного максимума ртути обсуждалась также Счастны и Стра-фельда [74] и Трассата с сотрудниками [75, 76]; статья [68] авторам этих публикаций была, по-видимому, неизвестна. В работе [74] сделана попытка определить коэффициенты активности хлорид-ионов в водных растворах хлорида калия, причем авторы не делают различия между реальной и химической активностью. Цепи, изучавшиеся авторами, содержали жидкостные границы, и в экспериментально найденные потенциалы нулевого заряда ртути вводились поправки на диффузионный потенциал, которые рассчитывали по уравнению Гендерсона. [19]
Однако для вычисления рН по уравнению (3.6) необходимо приписать коэффициенту активности хлорид-иона некоторое определенное значение, что возможно только с привлечением какого-либо внетермодинамического предположения. Ниже кратко охарактеризованы некоторые использованные в этих исследованиях предположения. [20]
Соотношение (13.5) между активностями ионов серебра и хлора в насыщенном растворе соли AgCl остается справедливым и в том случае, если изменить активность одного из них. Например, если добавить в раствор хорошо растворимую соль КС1, то активность хлорид-иона увеличивается, а активность ионов серебра соответственно уменьшается. [21]
В присутствии анионов, образующих с ионами серебра малорастворимое соединение ( AgCl, AgBr и др.), потенциал электрода зависит от активности ( концентрации) аниона. Например, в растворе, содержащем хлорид-ионы, потенциал серебряного электрода зависит от активности хлорид-ионов. [22]
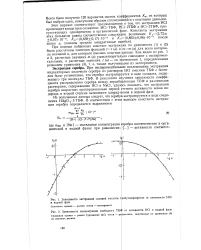 |
Зависимость экстракции соляной кислоты в водной фазе.| Зависимость концентрации свободного ТБ4. [23] |
При экспериментальнзм исследовании экстракции индикаторных количеств серебра из растворен НС1 смесями ТБФ с бензолом было установлено, что серебро экстрагируется в виде сольвата, содержащего три молекулы ТБФ. В результате изучения зависимости коэффициента распределения серебра между неразбавленным ТБФ и различными растворами, содержащими НС1 и NaCl, удалось показать, что экстракция серебра возрастает пропорционально первой степени активности ионов водорода и второй степени активности хлорид-ионов в водной фазе. [24]
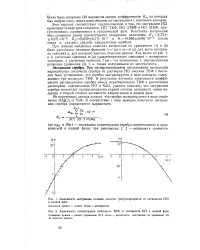 |
Зависимость экстракции соляной кислоты трибутилфосфатом от активности НС. в водной фазе.| Зависимость концентрации свободного ТБФ от активности НС1 в водной фазе. [25] |
При экспериментальном исследовании экстракции индикаторных количеств серебра из растворов НС1 смесями ТБФ с бензолом было установлено, что серебро экстрагируется в виде сольвата, содержащего три молекулы ТБФ. В результате изучения зависимости коэффициента распределения серебра между неразбавленным ТБФ и различными растворами, содержащими НС1 и NaCl, удалось показать, что экстракция серебра возрастает пропорционально первой степени активности ионов водорода и второй степени активности хлорид-ионов в водной фазе. [26]
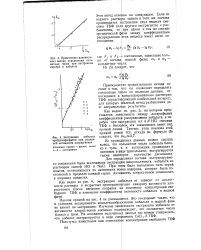 |
Применение сравнитель - где F. И.| Экстракции кобальта трибутилфосфатом при различной активности хлорид-ионов. [27] |
Наклон прямой на рис. 4 не уменьшается. Это показывает также, что в условиях эксперимента комплексообрааование кобальта в водной фазе не влияет на экстракцию. Изучение зависимости экстракции кобальта от активности хлорид-ионов косвенно подтверждает, что сольватное число близко к трем. На основании полученных данных мы можем утверждать, что кобальт экстрагируется в виде соединения СоС12 - ЗТБФ. [28]
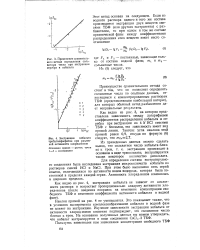 |
Применение сравнительного метода определения соль-ватных чисел при экстракции серебра и кобальта.| Экстракции кобальта трибутилфосфатом при различной активности хлорид-ионов. [29] |
Наклон прямой на рис. 4 не уменьшается. Это показывает также, что в условиях эксперимента комплексообразование кобальта в водной фазе не влияет на экстракцию. Изучение зависимости экстракции кобальта от активности хлорид-ионов косвенно подтверждает, что сольватное число близко к трем. На основании полученных данных мы можем утверждать, что кобальт экстрагируется в виде соединения СоС12 - ЗТБФ. [30]
Страницы: 1 2 3