Активность - электролит
Cтраница 2
Коэффициенты активности электролитов можно интерпретировать, а частично и предсказать теоретически. Начальное падение у при увеличении концентраций электролита ( см. рис. 2) объясняется электростатическим взаимодействием ионов, а последующее возрастание можно истолковать как следствие гидратации. [16]
Коэффициенты активности электролитов в любой их смеси, конечно, могут быть определены путем прямого эксперимента, однако такие измерения представляют самостоятельную исследовательскую задачу. В литературе могут быть найдены результаты таких измерений для большинства чистых электролитов и некоторых бинарных смесей наиболее распространенных электролитов, которые можно непосредственно применять для целей ионного обмена. Для некоторых смесей электролитов результаты таких измерений удовлетворительно описываются известным эмпирическим правилом Харнеда ( справедливым лишь при постоянной ионной силе смеси) [8] или некоторыми более сложными интерполяционными формулами. Если коэффициенты этих фортиул известны, то расчет коэффициента активности в смеси требуемого относительного состава не составляет труда: Весьма важна возможность расчета коэффициентов активности электролитов в смеси без предварительного проведения измерений. [17]
Коэффициент активности электролита в фазе ионита у может быть рассчитан из эксперимента по формуле ( III. Какие-либо другие независимые методы его определения неизвестны. [18]
Коэффициент активности электролита определяется экспериментально. [19]
Вычисление активности электролита сводится таким образом к вычислению электрической работы разделения его ионов. [20]
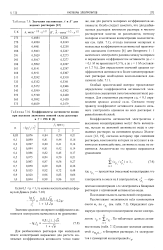 |
Значения постоянных А и В для водных растворов [ 12.| Коэффициенты активности ионов. [21] |
Коэффициенты активностей электролитов с высокими концентрациями могут быть вычислены, исходя из значений активности воды в смешанных растворах на основании правила Зданов-ского [12, 19], согласно которому при смешении растворов, компоненты которых не вступают в химическое взаимодействие, активность воды не изменяется. [22]
Коэффициент активности электролита возрастает при разбавлении раствора. [23]
Коэффициенты активности электролитов в водных растворах приводятся в моляльной шкале концентраций для температуры 25 С. За стандартное принято состояние электролита в гипотетическом одномоляльном водном растворе, обладающем свойствами идеального раствора. [24]
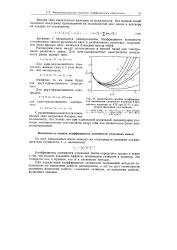 |
Зависимость средних коэффициентов активности хлористого водорода и бромистого водорода от Ym при 25 С в растворах щелочных галогенидов. [25] |
Коэффициенты активности электролитов одного валентного типа в разбавленных растворах, выраженные через ионную силу, являются близкими между собой. [26]
Коэффициент активности электролита часто называют средним коэффициентом активности и обозначают символом / в отличие от / 4 - коэффициентов активности отдельных ионов. [27]
Коэффициенты активности электролитов всегда принято выражать, используя в качестве стандартного состояния сравнения идеальный разоавлшшый раствор ( см. гл. [28]
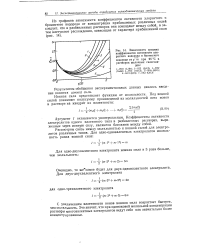 |
Зависимость средних коэффициентов активности хлористого водорода и бромистого водорода от т / ш при 25 С в растворах щелочных галогени-дов. [29] |
Коэффициенты активности электролитов одного валентного типа в разбавленных растворах, выраженные через ионную силу, являются близкими между собой. [30]
Страницы: 1 2 3 4