Активность - электролит
Cтраница 3
Мерой активности электролита является коэфициент, дающий отношение числа ионов, имеющихся в растворе, к числу ионов, которые могут образоваться при полной диссоциации. Эта величина, позднее названная степенью диссоциации, выражается отношением молярной электропроводности раствора при данном и при бесконечном разведении. [31]
Коэффициент активности электролита часто называют средним коэффициентом активности и обозначают символом / в отличие от Д - коэффициентов активности отдельных ионов. [32]
Коэффициенты активности электролитов типа соляной кислоты при концентрациях, значительно превышающих границу так называемой области Дебая-Хюккеля ( т 0 01), представляют с помощью более сложных выражений с одним или более подгоночным параметром. [33]
Опубликованные коэффициенты активности электролитов при средней моляльной концентрации ( определенной вышеописанным методом) учитывают как взаимодействие между ионами, так и взаимодействие ионов с растворителем. [34]
Средний коэффициент активности электролита, диссоциирующего на р видов ионов, согласно уравнению ( 48) гл. [35]
Опубликованные коэффициенты активности электролитов при средней ыоляльной концентрации ( определенной вышеописанным методом) учитывают как взаимодействие между ионами, так и взаимодействие ионов с растворителем. Необходимо проверить предположение о том, что значительная часть воды находится в связанном состоянии в той области макроиона, где величина электростатического потенциала высока. Если это так, то кинетической единицей в растворах многих электролитов является ион со сравнительно более прочно связанными молекулами воды. Определение параметра я, характеризующего в видоизмененном уравнении Дебая - Хюккеля размер иона, подтверждает это предположение. В любом случае концепция ионного связывания, которую можно объяснить, исходя из описанной ранее модели гибридного потенциала, требует присутствия воды между ионизованным макроионом, несущим электрический заряд, и связанными противоионами. Только при этом условии удается четко разграничить влияние электростатического взаимодействия и влияние ассоциации ионов. [36]
Определение коэффициентов активности электролитов в смешанных растворах двух электролитов с общим ионом чаще всего производится путем измерения активности растворителя с последующим использованием уравнения Гиббса - Дюгема. [37]
Зависимость коэффициентов активности электролитов от состава раствора является важной и сложной проблемой физической химии. Для бинарных растворов сильных электролитов существуют удовлетворительные способы описания, основанные на теории Дебая-Хюккеля. Ниже мы попытаемся показать, что обширны экспериментальные данные по смешанным растворам электролитов являются важным полигоном для испытания теорий. [38]
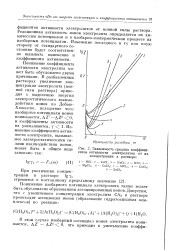 |
Зависимость средних коэффициентов активности электролитов от их концентрации в растворе. [39] |
Понижение коэффициента активности электролита может быть обусловлено двумя причинами. [40]
Между коэффициентом активности электролита и ионностью среды растворителя имеется определенная эмпирически установленная взаимосвязь. Коэффициент активности / данного электролита в растворе зависит только от ионности среды раствора. При одинаковом значении / коэффициент активности сохраняет свое постоянное значение независимо от вида остальных электролитов, присутствующих в растворе. Это правило справедливо как для электролита в целом, так и для каждого из составляющих его ионов в отдельности. [41]
Средний коэффициент активности электролита, диссоциирующего на р видов ионов, согласно уравнению ( 48) гл. [42]
Средний коэффициент активности электролита Y представляет собой среднее геометрическое из коэффициентов активности катиона и аниона, а средняя концентрация ионов электролита т - среднее геометрическое из концентраций катиона и аниона. [43]
При О С активность электролитов имеет вид: ННКОНК2СО3КЩР ННХКННКСаС12; при этом прочность значительно снижается для НН, Н2О и ННХК ( после 28 сут) и СаС12 ( после 180сут); прочность С3А постоянно растет лишь в КЩР и ННК. [44]
Как известно, активность электролита в растворе определяется произведением активностей составляющих его ионов. [45]
Страницы: 1 2 3 4