Активность - галоген
Cтраница 2
Расположите в порядке убывающей активности галогена галогенпроизводные: хлористый винил, хлористый аллил, хлористый пропил. [16]
Благодаря тому, что активность галогенов уменьшается от фтора к иоду, каждый галоген можно вытеснять из его соединений с помощью более активных галогенов: иод вытесняется фтором, хлором и бромом; бром - фтором и хлором; хлор - только фтором. [17]
Благодаря тому, что активность галогенов уменьшается от фтора к йоду, каждый галоген можно вытеснять из его соединений с помощью более активных галогенов: йод вытесняется фтором, хлором и бромом; бром - фтором и хлором; хлор - только фтором. [18]
Сравните: а) активность галогена а -, Р - и у-хлорпири-динов в реакциях нуклеофильного замещения; б) отношение к действию азотистой кислоты а -, Р - и - у-аминопиридинов; в) строение и свойства а -, р - и - у-гидроксипиридинов. [19]
При взаимодействии с непредельными углеводородами активность галогенов также понижается с повышением их молекулярного веса: легче всех реагирует фтор, труднее всех-иод. [20]
Реакционная способность алкилирующих средств падает по мере уменьшения активности галогена ( соответственно кислотного остатка) в следующем ряду: аллилгалогениды бензилгалогениды а-галогенокетоны алкилсульфаты алкил-я-толуолсульфонаты ( тозилаты) алкилгало-гениды. Дикарбонильное соединение обычно переводят в натриевое производное действием алкоголята натрия. В результате побочных реакций при этом из алкилирующего агента могут образовываться простые эфиры и олефины. Эти реакции особенно легко идут у разветвленных галогенидов ( см. гл. IV), что служит причиной сильного уменьшения выходов при реакциях с подобными галогенидами. С трет-бутилгалогенидами уже не удается получить приемлемых выходов. [21]
Реакционная способность алкилирующих средств падает по мере уменьшения активности галогена ( соответственно кислотного остатка) в следующем ряду: аллилгалогениды бензилгалогениды а-галогенокетоны алкилсульфаты алкил-п-толуолсульфонаты ( тозилаты) алкилгало-гениды. Дикарбонильное соединение обычно переводят в натриевое производное действием алкоголята натрия. В результате побочных реакций при этом из алкилирующего агента могут образовываться простые зфирыи олефины. Эти реакции особенно легко идут у разветвленных галогенидов ( см. гл. IV), что служит причиной сильного уменьшения выходов при реакциях с подобными галогенидами. С трет-бутилгалогенидами уже не удается получить приемлемых выходов. [22]
Эти элементы обладают высокой химической активностью, несколько уступающей активности галогенов. В виде электронейтральных атомов и простых веществ для них характерна окислительная способность. Наиболее заметно окислительные свойства проявляются у кислорода и серы. [23]
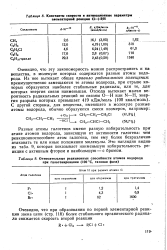 |
Константы скорости и актнвационные параметры элементарное реакции C1 - RH.| Относительные реакционные способности атомов водорода при галогенировании ( 100 С, газовая фаза. [24] |
Разные атомы галогенов имеют разную избирательность при-атаке атомов водорода, зависящую от активности галогена: чем реакционноспособнее атом галогена, тем ему более безразлично-атаковать те или иные положения молекулы. Это наглядно видно-из табл. 9, которая показывает наименьшую избирательность реакции с активным фтором и наибольшую - с бромом. [25]
 |
Относительные реакционные способности атомов водорода при галогенировании ( 100 С, газовая фаза.| Тепловые эффекты стадий продолжения цепи. [26] |
Разные атомы галогенов проявляют разную избирательность при атаке атомов водорода, зависящую от активности галогена; чем реакционноспособнее атом галогена, тем менее избирательно он атакует те или иные положения молекулы. Это наглядно видно из данных табл. 17, которые показывают наименьшую избирательность реакции с активным фтором и наибольшую - с бромом. [27]
Из приведенных данных видно, что сродство к электрону и, следовательно, активность галогенов последовательно снижается от хлора к иоду. Однако при переходе от фтора к хлору наблюдается обратное соотношение, хотя известно, что по своей активности хлор заметно уступает фтору. [28]
Если галоген удален от двойной связи или от бензольного кольца на два и более атома углерода, то в таких соединениях активность галогена близка к активности его в алкилгалогенидах. [29]
С другой стороны, большое значение имеет структура молекулы и наличие заместителей, сильно влияющих на реакционную способность галогенпроизводных: так, наличие соседней непредельной группы увеличивает активность галогена. Особенно сильно сказывается влияние гетероатомов, несущих неподеленную пару электронов, которые стабилизируют переходное состояние. Кроме этого, присутствие, например, карбонильной группы благоприятствует подходу нуклеофильного реагента в результате уменьшения электронной плотности на атоме углерода, несущем галоген. [30]
Страницы: 1 2 3