Каталитическая активность - фермент
Cтраница 2
Так как в процессе взаимодействия с субстратом каталитическая активность ферментов часто изменяется, многие исследователи предпочитают пользоваться начальным наклоном кривой концентрация субстрата - время. [16]
Согласно рекомендации международной комиссии по номенклатуре ферментов каталитическая активность фермента может быть охарактеризована его молекулярной активностью, под которой следует понимать число молекул данного субстрата или эквивалентов затронутых групп, превращаемых за 1 м ин одной молекулой фермента при оптимальной концентрации субстрата. [17]
Согласно рекомендации международной комиссии по номенклатуре ферментов каталитическая активность фермента может быть охарактеризована его молекулярной активностью, под которой следует понимать число молекул данного субстрата или эквивалентов затронутых групп, превращаемых за 1 мин-одной молекулой фермента при оптимальной концентрации субстрата. [18]
Определяя его количество, можно судить о каталитической активности фермента. Седогептулозо-7 - фосфат определяют по цветной реакции с цистеином в присутствии серной кислоты. [19]
Приведенные выше данные показывают также, что изменение общей каталитической активности фермента в 105 раз не может определяться изменениями природы аксиального лиганда ( X) - предположение, которое прежде всего приходит в голову специалистам в области химии комплексных соединений. Оно обусловлено какими-то более тонкими эффектами белка. [20]
Вообще говоря, возможны четыре типа факторов, определяющих каталитическую активность фермента. Во-первых, необходим химический аппарат в активном центре, способный деформировать или поляризовать химические связи субстрата, что последний более реакционноспособным, во-вторых - центр, иммобилизующий субстрат в правильном положении к гим реакционным группам, участвующим в химическом превращении, в-третьих - правильная и точная ориентация субстрата, благодаря которой каждая стадия реакции проходит с минимальным колебательным или вращательным движением вокруг связей субстрата, и, наконец, в-четвертых, способ фиксирования субстрата должен способствовать понижению энергии активации ферментсубстратного комплекса в переходном состоянии. Соответствующее распределение зарядов в активном центре и геометрия активного центра входят в число факторов, определяющих снижение суммарной энтропии переходного состояния. Все эти факторы в той или иной степени влияют на структуру активного центра фермента, и их нельзя рассматривать изолированно, вне связи друг с другом. [21]
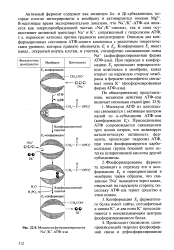 |
Механизм функционирования Na / K - ATO - a3bi. [22] |
Присоединение АТФ сопровождается связыванием трех ионов натрия, что активирует каталитическую активность фермента, происходит гидролиз АТФ, при этом фосфорилируется карбоксильная группа боковой цепи остатка аспарагиновой кислоты другой субъединицы. [23]
Присоединение АТФ сопровождается связыванием 3 ионов натрия, что активирует каталитическую активность фермента, происходит гидролиз АТФ, при этом фосфорилируется карбоксильная группа боковой цепи остатка аспарагиновой кислоты другой субъединицы. [24]
Можно считать установленным, что только два атома цинка определяют каталитическую активность фермента. [25]
Вещество ( обычно небольшая молекула), которое необходимо для проявления каталитической активности фермента. [26]
Для ответа на вопрос, приводит ли модификация функциональной группы к полному исчезновению каталитической активности фермента или к уменьшению его каталитической эффективности, Кошлапд и сотрудники использовали метод все или ничего. При применении этого метода время протекания реакции не играет существенной роли, и фермент оставляют стоять с субстратом до тех пор, пока все группы фермента, способные ацнлироваться, не будут проацнлпрованы. В этом случае как нативная молекула фермента, так и молекула фермента с 10 % - ной активностью, оцененной обычными методами измерения скорости, должны быть полностью проацилированы, и только инертный фермент не должен вступать в реакцию. В исследованиях Кошланда [79] использовался начальный всплеск, сопровождающий ацилирование химотрипсина N-гранс-циннамоилпмидазо - лом. [27]
Коферменты ( коэнзимы) - сложные органические соединения небелковой природы, необходимые для проявления каталитической активности ферментов. Некоторые коферменты очень прочно связаны с ферментным белком ( апоферментом), например тиаминпирофосфат, другие связаны с белком слабо, например НАД. Многие коферменты содержат в качестве активных компонентов вещества, присутствующие в организме в следовых количествах, например рибофлавины, тиамин, пантотеновую кислоту или никотияамид, являющиеся витаминами. Обычно коферменты играют роль промежуточных переносчиков электронов или функциональных групп, которые в результате ферментативной реакции передаются с одного соединения на другое. [28]
По кинетике омыления связи в пятичленном циклическом эфире ( ангидриде) можно - легко измерять каталитическую активность фермента. Много данных получено путем деградации фермента РНК-азы. [29]
Как будет показано, не всегда возможно провести строгую границу между этими механизмами; несомненно, каталитическая активность фермента обусловлена не одним простым механизмом. Ферментативные реакции, а также и некоторые простые теории будут обсуждаться лишь в тех случаях, когда известно что-либо о движущих силах каталитического процесса или когда к объяснению катализа можно приложить простую теорию без существенных оговорок. Рассмотрение неферментативных, и в еще большей степени ферментативных, реакций носит по необходимости эмпирический и качественный ( в лучшем случае полуколичественный) характер. Однако во многих областях катализа намечаются значительные успехи, и поэтому автор не сомневается, что через несколько лет в результате развития науки данная книга устареет. [30]
Страницы: 1 2 3 4