Каталитическая активность - фермент
Cтраница 3
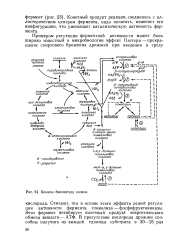 |
Химизм биосинтеза лизина. [31] |
Конечный продукт реакции, соединяясь с ал-лостерическим центром фермента, надо полагать, изменяет его конфигурацию, что уменьшает каталитическую активность фермента. [32]
Всем приведенным выше наблюдениям можно, однако, дать и совершенно иное толкование, а именно: можно предположить, что каталитическая активность фермента зависит от скопления большого количества ионных групп на ограниченном пространстве белковой молекулы фермента. Хорошо известно ( хотя это явление до сих пор остается необъясненным), что активность ионов в концентрированных растворах щелочей или минеральных солей более чем в 100 раз выше теоретической величины. [33]
Помимо энергии, биогенез ДНК требует наличия специфических ферментов, катализирующих отдельные этапы синтеза, и множества белковых факторов, абсолютно необходимых для регулирования процесса репликации и проявления каталитической активности ферментов. [34]
Все ферменты обладают строгой специфичностью по отношению к стратам, на которые они действ уют менты можно инактивировать путем необратимой модификации некоторых функциональных групп, имеющих важное значение для каталитической активности ферментов. [36]
Действие магния как активатора проявляется в том, что фермент и субстрат связаны с магнием в виде вну-трикомплексных органических соединений ( магний не образует ионов), а это усиливает влияние магния на каталитическую активность ферментов. [37]
Ферменты - очень сложные органические молекулы, представляющие собой глобулярные белки, Их каталитические центры состоят их ряда атомных групп, природа и взаимное расположение которых в пространстве строго детерминировано, что, собственно, и определяет каталитическую активность фермента. [38]
 |
Модели строения некоторых олигомерных ферментов. [39] |
Считают, что процесс олигомеризации придает субъединицам белков повышенную стабильность и устойчивость по отношению к действию денатурирующих агентов, включая нагревание, влияние протеиназ и др. Однако на нынешнем этапе знаний нельзя ответить однозначно на вопрос о существенности четвертичной структуры для каталитической активности ферментов, поскольку пока отсутствуют методы, позволяющие в мягких условиях разрушить только лишь четвертичную структуру. Применяемые обычно методы жесткой обработки ( экстремальные значения рН, высокие концентрации гуанидинхлорида или мочевины) приводят к разрушению не только четвертичной структуры, но и вторичной и третичной структур стабильного олигомерного фермента, протомеры которого оказываются денатурированными и, как следствие этого, лишенными биологической активности. [40]
Аллостерические ферменты имеют каталитический и регуля-торный ( аллостерический) центры, пространственно разобщенные, но функционально тесно взаимосвязанные. Каталитическая активность фермента меняется в результате связывания с его регу-ляторным центром определенных метаболитов, называемых э ф-фекторами. [41]
В любом случае трудно провести четкое разграничение между стабилизацией иона карбония близко расположенной карбокси-латной группой, как для карбокатионного механизма, и образованием ковалентной связи между ними, как при нуклеофильном катализе ( [79], с. Возможно, каталитическая активность фермента отражает тонкий баланс между этими двумя экстремальными случаями. [42]
При внесении ничтожных количеств молибдена урожайность бобовых резко возрастает. Соединения молибдена повышают каталитическую активность ферментов, участвующих в реакциях связывания атмосферного азота бактериями. [43]
Активность большинства ферментов зависит от содержания в реакционной среде различных веществ. Вещества, которые повышают каталитическую активность ферментов, называются активаторами. [44]
Активный центр фермента ( активная зона фермента) - та часть молекулы ферментативного белка, которая соединяется с субстратом ( и кофакторами) и от которой зависят каталитические свойства молекулы. Он обусловливает специфичность и каталитическую активность фермента и представляет собой структуру определенной степени сложности, приспособленную для тесного сближения и взаимрдействия с молекулой субстрата или с частями ее, непосредственно участвующими в реакции. Взаимодействие между активным центром и субстратом может осуществляться лишь при тесном сближении на расстояние 15 - 20 А. [45]
Страницы: 1 2 3 4
