Более высокая химическая активность
Cтраница 1
Более высокая химическая активность гексагональной и аморфной GeO2 по сравнению с тетрагональной может быть объяснена следующим образом. [1]
 |
Схема прибора для определения электропроводности раствора. [2] |
Очевидно, более высокую химическую активность и электропроводность серной кислоты по сравнению с уксусной можно объяснить тем обстоятельством, что в водном растворе первой из кислот концентрация ионов Н выше, чем в растворе второй. [3]
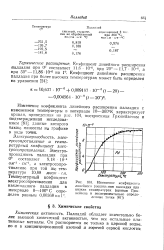 |
Изменение коэфициента линейного расширения палладия при низких температурах ( кривая Грю-нейзена и экспериментально определенные точки. [4] |
Палладий обладает значительно более высокой химической активностью, чем все остальные платиновые металлы. [5]
По сравнению с кислородом озон обладает более высокой химической активностью. Активность озона объясняется особенностью строения его молекул. Ряд горючих, в том числе углеводороды непредельного ряда, при контакте с озоном или со смесью озона и жидкого кислорода способны самовоспламеняться. [6]
As, Sb, Bi обладают более высокой химической активностью. Они могут окисляться и восстанавливаться: легко реагируют с рядом неметаллов - кислородом, галогенами, серой и др., многими металлами. С кислотами, не являющимися окислителями, они не взаимодействуют, при нагревании реагируют с кислотами-окислителями. При нагревании в воде и в растворах щелочей белый и красный фосфор диспропорционирует. Металлические модификации Sb и Bi устойчивы к воде и щелочам. As в воде не растворяется, щелочами окисляется при кипячении. При переходе от As к Bi стабилизируется более низкая степень окисления - 3; химическая связь в соединениях становится все более ионной; основные свойства оксидов и гидроксидов усиливаются. [7]
As, Sb, Bi обладают более высокой химической активностью. Они могут окисляться и восстанавливаться: легко реагируют с рядом неметаллов - кислородом, галогенами, серой и др., многими металлами. С кислотами, не являющимися окислителями, они не взаимодействуют, при нагревании реагируют с кислотами-окислителями. При нагревании в воде и в растворах щелочей белый и красный фосфор диспропорционирует. Металлические модификации Sb и Bi устойчивы к воде и щелочам. As в воде не растворяется, щелочами окисляется при кипячении. При переходе от As к Bi стабилизируется более низкая степень окисления - - - - - 3; химическая связь в соединениях становится все более ионной; основные свойства оксидов и гидроксидов усиливаются. [8]
As, Sb, Bi обладают более высокой химической активностью. Они могут окисляться и восстанавливаться: легко реагируют с рядом неметаллов - кислородом, галогенами, серой и др., многими металлами. С кислотами, не являющимися окислителями, они не взаимодействуют, при нагревании реагируют с кислотами-окислителями. При нагревании в воде и в растворах щелочей белый и красный фосфор диспропорционирует. Металлические модификации Sb и Bi устойчивы к воде и щелочам. As в воде не растворяется, щелочами окисляется при кипячении. При переходе от As к Bi стабилизируется более низкая степень окисления - - [ - 3; химическая связь в соединениях становится все более ионной; основные свойства оксидов и гидроксидов усиливаются. [9]
При этом получаются высокодисперсные препараты, обладающие более высокой химической активностью, чем гидрид, полученный из магния и водорода. [10]
По химическим свойствам калий близок к натрию, но имеет более высокую химическую активность. По этой причине получение калия представляет значительно большие трудности, чем натрия, и последний заменяет калий, там где применение их более или менее равноценно. В этом соединении, получающемся при окислении калия, содержится теоретически 33 8 % активного кислорода, тогда как при окислении натрия в обычных условиях получается перекись натрия Na2O2, имеющая теоретически только 20 5 % активного кислорода. [11]
По химическим свойствам калий близок к натрию, но имеет более высокую химическую активность. По этой причине получение калия представляет значительно большие трудности, чем натрия, и последний заменяет калий, там где применение их более или менее равноценно. В этом соединении, получающемся при окислении калия, содержится теоретически 33 8 % активного кислорода, тогда как при окислении натрия в обычных условиях получается пероксид натрия Na2O2, имеющий теоретически только 20 5 % активного кислорода. [12]
По химическим свойствам калий близок к натрию, но имеет более высокую химическую активность. По этой причине получение калия представляет значительно большие трудности, чем натрия, и последний заменяет калий, там где применение их более или менее равноценно. В этом соединении, получающемся при окислении калия, содержится теоретически 33 8 % активного кислорода, тогда как при окислении натрия в обычных условиях получается перекись натрия Na2Oa, имеющая теоретически только 20 5 % активного кислорода. [13]
 |
Кристаллическая структура нитрида бора. [14] |
Разница в механизмах смазывания графита и MoS2 обусловлена, главным образом, более высокой химической активностью последнего. Графит хорошо работает во влажном воздухе, плохо в сухом кислороде и совершенно не проявляет смазочных свойств в сухом азоте. Дисульфид молибдена, наоборот, хорошо работает в сухом азоте и кислороде и плохо - во влажном воздухе. [15]
Страницы: 1 2 3