Iiia-группа
Cтраница 1
IIIA-группы солеобразны, но в А1С13 сохраняется значительное влияние ковалентных полярных связей. Так, например, А1С13 дает диаметр А12С1, растворимый в органических растворителях. [1]
В IIIA-группе от А1 к Т1 основные свойства оксидов усилива - ются, и возрастает склонность к снижению степеней окисления элементов в соединениях. Поэтому АЬОз и Оа2Оз плавятся без разложения, IibOs при 850 С начинает переходить в 1пО - 1п2Оз, а ТЬОз отщепляет 02 и превращается в ТЬО уже при 90 С. [2]
В воде оксиды металлов IIIA-группы нерастворимы; кристаллические модификации А12О3 и Ga2O3 нерастворимы и в кислотах, а в щелочах они растворяются с трудом при длительном нагревании. [3]
В свободном состоянии элементы IIIA-группы в природе не встречаются. Наиболее распространенным из них является алюминий, его кларк равен 7 6 % - третье место по распространенности после кислорода и кремния и первое среди металлов. Кларк бора - 2 10 %; в своих минералах бор всегда связан с кислородом, впрочем как и остальные элементы IIIA-группы. [4]
Как изменяется кислотно-основный характер оксидов металлов IIIA-группы при увеличении их атомной массы. [5]
В этой главе рассматриваются элементы трех групп периодической системы: IIIA-группы бора, IVA-группы углерода и группы VA - сурьма и висмут. Атомы их характеризуются застройкой электронами р-подуровня наружного уровня. У этих элементов, за исключением алюминия, восстановительная способность выражена сравнительно слабо. В свободном состоянии они характеризуются свойствами, отличающимися от свойств типичных металлов. Некоторые из соответствующих элементарных веществ ( кремний, германий) являются полупроводниками, иные ( бор, алмаз) отличаются большой твердостью. Значение в современной технике как элементарных веществ, так и некоторых соединений этих элементов очень велико. [6]
 |
Граничные значения Z при данном / по В. М. Клечковскому. [7] |
К таковым относятся: алюминий, галлий, индий и таллий, которые вместе с бором составляют IIIA-группу элементов. [8]
Как правило, в пределах данной А-группы у элементов с ростом порядкового номера уменьшается тенденция к образованию соединений с высшей ковалентностью и растет тенденция к образованию соединений с низшей ковалентностью. Так, в IIIA-группе низшую возможную кова-лентность проявляет лишь таллий Т1 - элемент с самым большим порядковым номером в этой группе. Остальные элементы постоянно трехковалентны. В четвертой группе углерод С и кремний Si исключительно четырехковалентны. У германия Ge и олова Sn преобладают соединения, в которых они четырехковалентны, но существуют соединения и с двухковалентными германием и оловом. Свинец РЬ почти исключительно двухковалентен. Аналогичная картина имеет место и в остальных А-группах. Описанную закономерность объясняют по-разному. Одно из объяснений заключается в том, что в атомах с большими порядковыми номерами из-за большого количества электронов в них при образовании ковалентных связей сверх минимально возможного их числа отталкивание между внутренними электронами преобладает над действием притяжения за счет перекрывания валентных электронных облаков. [9]
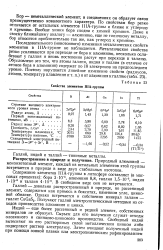 |
Свойства элементов IIIA-группы. [10] |
Бор неметаллический элемент; в соединениях он образует связи преимущественно ковалентного характера. По свойствам бор резко отличается от остальных элементов IIIA-группы и ближе к углероду и кремнию. Вообще химия бора сходна с химией кремния. Даже к своему ближайшему аналогу - алюминию, еще не типичному металлу, бор относится приблизительно так же, как углерод к кремнию. [11]
У элементов, атомы которых заполняют электронами р-орбитали, на внешнем уровне находится 3 и более электронов. Это характерно для элементов с неметаллическими свойствами, а металлические свойства сохраняют лишь в IIIA-группе Al, Ga, In и Т1, в IVA-группе - Sn и РЬ. В V группе Sb и Bi только условно можно рассматривать как металлы, поскольку им присущи многие неметаллические свойства. Все остальные - элементы относят к неметаллам. [12]
Полупроводником является и бор В - первый элемент IIIA-группы, в которую входят еще четыре металла. [13]
В свободном состоянии элементы IIIA-группы в природе не встречаются. Наиболее распространенным из них является алюминий, его кларк равен 7 6 % - третье место по распространенности после кислорода и кремния и первое среди металлов. Кларк бора - 2 10 %; в своих минералах бор всегда связан с кислородом, впрочем как и остальные элементы IIIA-группы. [14]
При переходе от s - металлов к р-метал-лам отмечается увеличение числа электронов ( до 3 - 4) на внешнем уровне атомов за счет заполнения ими р-подуровня. Это приводит к снижению восстановительной способности элементов и частичной утрате некоторыми из них типично металлических черт: мягкости, легкоплавкости. Такие металлы, как алюминий А1, галлий Ga, индий In и таллий Т1, атомы которых содержат на внешнем уровне по два s - и по одному р-электро-ну, входят в состав IIIA-группы периодической системы элементов Д. И. Менделеева, и их называютр1 - элементами. Олово Sn и свинец РЬ, в атомах которых имеется по два внешних р-электрона, входят в состав IVA-группы, и их называют р2 - э лементами. [15]
Страницы: 1 2