L-слой
Cтраница 2
Основной терм лития определяется единственным электроном L-слоя. [16]
В действительности при переходе электронов из L-слоя на К наблюдается несколько частот, отвечающих различным энергиям электронов L-слоя. [17]
При переходе электрона в атоме с L-слоя на К-слой испускаются рентгеновские лучи с длиной волны 0 788 А. Для Х - серии постоянная экранирования равна единице. [18]
Состояние с главным квантовым числом п 2 образует L-слой. В состоянии s возможно одно магнитное квантовое число и два электрона с разными спинами. Всего в состоянии s может быть не более двух электронов. В состоянии р возможно три магнитных квантовых числа и два различных спина, а всего шесть электронов с разными квантовыми состояниями. [19]
У следующего элемента, лития, начинается застройка L-слоя. Третий электрон лития попадает в 25-состояние. [20]
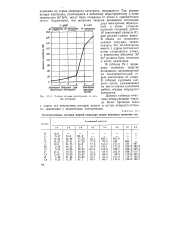 |
Последовательные значения энергий ионизации атомов некоторых элементов ( эв. [21] |
Так, первые четыре электрона, относящиеся к внешнему недостроенному L-слою ( электроны 2s2 2p2), могут быть оторваны-от атома С сравнительно легко. [22]
Начиная с лития, в атомах последующих элементов формируется L-слой ( я-2), так как попадание третьего электрона в первый слой означало бы нарушение запрета Паули. Второй электронный слой завершается у неона; у него заполнены и s - и р-оболочки. В атомах элементов от натрия до аргона комплектуется третий слой подобно второму. [23]
В атомах элементов, следующих за гелием, формируется L-слой ( п 2), так как наличие третьего электрона в первом слое означало бы нарушение запрета Паули. Второй электронный слой завершается у неона; у него заполнены и s -, и р-оболочки. В атомах элементов от натрия до аргона комплектуется третий электронный слой подобно второму. [24]
В атомах элементов, следующих за гелием, формируется L-слой ( л - 2), так как наличие третьего электрона в первом слое означало бы нарушение запрета Паули. Второй электронный слой завершается у неона; у него заполнены и s -, и р-оболочки. В атомах-элементов от натрия до аргона комплектуется третий электронный слой подобно второму. [25]
Два атома лития могут образовать молекулу, объединяя электроны L-слоя в одну оболочку. [26]
С наблюдается несколько частот, отвечающих различным энергиям электронов L-слоя. [27]
Два атома лития могут образовать молекулу, объединяя электроны L-слоя в одну оболочку. [28]
В атоме вольфрама электрон перешел с Л1 - слоя на L-слой. [29]
У элементов второго периода начинается заполнение L-энер-гетического уровня, или L-слоя. Второй период начинается с Li, в атоме которого имеется три электрона. Два из них находятся в / ( - слое, как и у атома гелия, третий электрон располагается в L-слое. У элементов второго периода также сначала заполняется s - подуровень, а затем р-подуровень. У последнего элемента этого периода - неона все s - и р-орбитали при п 2 заполнены. Элементы, в атомах которых в последнюю очередь заполняется s - подуровень, называются s - э л е м е н т а м и, а р-подуровень - р-э лементами. Электронное строение атомов благородных газов служит остовом строения атомов последующих элементов. [30]
Страницы: 1 2 3 4