Нафтильная группа
Cтраница 2
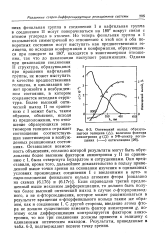 |
Оптический выход образующегося гелицена ( А, величина фактора анизотропии g ( О и УФ-спектр поглощения ( - - - - - - октагелицена. [16] |
Но теперь фенильная группа в I оказывается симметричной по отношению к этой оси и оба поворотных состояния могут выступать как предшественники ге-лицена, но исходная конформация и конформация, образующаяся при повороте на 180, находятся в энантиомерном отношении, так что до циклизации наступает рацемизация. Однако при циклизации соединения II структура, образующаяся при вращении нафтильной группы, не может выступать в качестве предшественника гелицена, и циклизация может произойти в возбужденном состоянии, в котором сохраняется исходная структура. Более высокий оптический выход II по сравнению с I может быть, таким образом, объяснен, исходя из предположения, что отношение образующихся энан-тиомеров гелицена отражает соотношение соответствующих энантиомеров в возбужденных реакционных состояниях. Оставшаяся возможность объяснения, согласно которой результаты могут быть обусловлены более высоким фактором анизотропии у II по сравнению с I, была отвергнута Бухардтом и сотрудниками. Если справедлив третий предложенный выше механизм дифференциации, то должен быть получен более высокий оптический выход в случае о-фторпроизвод-ного, а не n - фторсоединения, которое может рацемизоваться в результате вращения м-фторфенильного кольца таким же образом, как и соединение I. С другой стороны, введение атома фтора не должно существенно изменять фактор анизотропии g, поэтому если дифференциация контролируется фактором анизотропии, то все три соединения должны привести к гелицену с одинаковым оптическим выходом. Результаты, приведенные в табл. 6 - 3, подтверждают первую точку зрения. [17]
 |
Энергия возбуждения фосфороводородов НОСТЬ ТОГО Же ПОрЯДКа, ЧТО И. [18] |
Как в случае динафтилфенилфосфина ( Е / г - 2255 мв), так и нафтилдифе-нилфосфина ( Е / г - 2270 мв) можно наблюдать подобные потенциалы полуволны. Из этого следует, что первичный переход электрона происходит в нафтильную группу. [19]
В присутствии третичного амина окисление тормозится. Инги-бирующее действие, возможно, связано с отрывом атома водорода, находящегося в а-положении к нафтильной группе. Действительно, замещение водорода в этом положении метальной группой резко уменьшает период индукции. [20]
Они отмечают, что фе-нильная группа на 20 - 30 % менее эффективна в сопряжении, чем двойная связь, а нафтильная группа менее эффективна, чем фениль-ная. [21]
Наши исследования показали, что люминесценция карбонильных производных дифенила и нафталина может быть приписана внутримолекулярному переносу энергии возбуждения. Это объясняет отсутствие в этих соединениях спектра флуоресценции, примыкающего к первому максимуму поглощения, и наличие только спектра фосфоресценции, характерного для дифенильной или нафтильной группы. В структуре спектров фосфоресценции мы не встречаем частоты 1600 - 1700 см 1 группы СО, но только частоты ароматических колец 1400 см 1 для фенил-4 - дифенилкетона и частоты нафталина в ацетилнафталинах. [22]
Некоторые аллены из-за стерических трудностей или вследствие отравления катализатора исключительно устойчивы по отношению к каталитическому гидрированию. Здесь, очевидно, объемистая нафтильная группа препятствует гладкому протеканию реакции. Довольно удивительно, что столь же громоздкий аллен 84t с тяжелыми три-фенилметильными группами поглощает два моля водорода в присутствии платинового катализатора. [23]
Изотопное соотношение указывает на присутствие одного атома хлора. Для обоих ионов можно предположить несколько возможных структур, однако выбор конкретной формулы затруднен. Ясно только, что разница между двумя наблюдаемыми массами соответствует СюН7, возможно нафтильной группе. [24]
На рис 5Л4 в проекции Ньюмена представлена конфигурация комплексов ( S) - 201 с солями / - аминоэфира ( более устойчивый комплекс) и й-аминоэфир & Предполагается, что ацильный атом углерода является тетраэдрическим ии-термедиатом в переходном состоянии и служит оптически активным центром при этом я-нитрофеноксигруппа направлена вверх перпендикулярно плоскости рисунка, а гидроксильная группа - вниз. Сравнивая структуры комллек сов а и б, легко видеть, что в случае а относительно большая группа R направлена в свободное пространство, тогда как в случае б группа R направлена в сторону стерического барьера. Хозяин ( S) - 201 с противоположной ориентацией нафтильных групп естественно проявляет противоположную пространственную избирательность. Работы Крама и его сотрудников занимают важное место среди исследований ферментативных реакций, поскольку позволяют создать новые катализаторы, аналогичные по действию. Химические реакции, как известно, основываются ни случайных столкновениях молекул. Реакции с - использованием асимметрических краун-эфиров, которые имеют способность к хиральному распознаванию и к удержанию реагентов в комплексе, позволят, как ожидают, создать процессы, имитирующие биохимические реакции. [25]
На рис 5Л4 в проекции Ньюмена представлена конфигурация комплексов ( S) - 201 с солями / - аминоэфира ( более устойчивый комплекс) и d - аминоэфир Предполагается что ацильный атом углерода является тетраэдрическим ии-термедиатом в переходном состоянии и служит оптически активным центром при этом я-нитрофеноксигруппа направлена вверх перпендикулярно плоскости рисунка, а гидроксильная группа - вниз. Сравнивая структуры комллек сов а и б, легко видеть что в случае а относительно большая группа R направлена в свободное пространство тогда как в случае б группа R направлена в сторону стерического барьера. Эта разница будет проявляться в поведении d - и I -аминокислот так как центром ньюменовской проекции служит асимме. Хозяин ( S) - 201 с противоположной ориентацией нафтильных групп естественно проявляет противоположную пространственную избирательность. Работы Крама и его сотрудников занимают важное место среди исследований ферментативных реакций, поскольку позволяют создать новые катализаторы, аналогичные по действию. Химические реакции как известно, основываются ни случайных столкновениях молекул. Реакции с - использованием асимметрических краун-эфиров которые имеют способность к хиральному распознаванию и к удержанию реагентов в комплексе, позволят, как ожидают, создать процессы, имитирующие биохимические реакции. [26]
Связь в этом случае осуществляется атомом серы. Так как тионалид легко окисляется, его часто применяют в присутствии подходящего восстановителя, например гидразина. Во многих случаях представляется вероятной координация иона металла также и с атомом кислорода или азота с образованием металлтионалидных комплексов, содержащих пятичленный хе-латный цикл. Для гравиметрических определений образующиеся осадки применяют не очень часто. Аналог тионалида, анилид тио-гликолевой кислоты, содержит ту же группировку, и его применяют для этих же целей, но вследствие замены нафтильной группы на фенильную его комплексы с металлами более растворимы. [27]
Александер и Чарлзби [45, 46] нашли, что сополимер изобути-лена с 20 % стирола требует в среднем 32 эв для одного разрыва главной цепи по сравнению с 17 - 20 эв для полиизобути-лена. Здесь положение фенильных групп по отношению костальным частям молекулы точно не определено. Дальнейшие доказательства получены теми же авторами при измерении дозы реакторного излучения, необходимой для создания сплошной пространственной сетки в ряду замещенных додеканов. Образование сплошной сетки с желатинированием и возникновением неплавкости наступает тогда, когда одна поперечная связь приходится на средневесовую молекулу. Для самого додекана требуется 27 реакторных единиц. Присоединение насыщенной полициклической водородной группы ( группы 2 -декалила) вблизи середины цепи несколько увеличивает дозу, необходимую для возникновения неплавкости. Данные табл. 6 подтверждают существование заметного стабилизирующего эффекта. Этот эффект не может быть обусловлен в основном пространственными причинами, так как он значительно больше, чем эффект, создаваемый насыщенной 2 -дека-лил - группой, имеющей ту же величину. Он, по-видимому, спадает достаточно быстро с увеличением расстояния вдоль цепи, а поэтому нафтильные группы, расположенные в конце цепи, менее эффективны, чем занимающие положение ближе к центру. Эти результаты достаточно доказательны лишь в соединении с другими данными; взятые сами по себе, они не приводят к однозначному заключению, так как могут быть объяснены на основании предположения, что ароматические группы ускоряют деструкцию, а не задерживают сшивание. [28]
Страницы: 1 2