N-анион
Cтраница 1
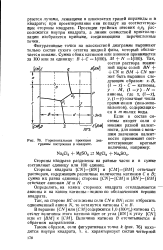 |
Горизонтальная проекция граммы построения в квадрате. [1] |
N-анионы, где х, ( 1 - х), у, ( 1-у) означают числа грамм-ионов ( ион-эквивалентов), содержащихся в т молях воды. [2]
Сближение NH-кислот-ности пентафтор - и 4-нитродифениламинов также говорит в пользу резонансного вклада в стабилизацию N-анионов этих соединений, тогда как несколько больший ацидифицирующий. NH-кислотности пентафторанилина и 4-нитро-анилина связан со значительно большим вкладом резонансного эфф екта, стабилизирующего N-анион последнего соединения. [3]
Это можно объяснить тем, что метильная группа в re - положении вызывает повышение электронной плотности у атома азота N-аниона натриевой соли продукта присоединения, что приводит к усилению атаки азота на атом фосфора, и олефинирование протекает без нагревания. В случае о-изомера дефосфонирования в тех же условиях не происходит из-за пространственного влияния метильной группы, которое, по-видимому, проявляется в понижении нуклеофильности N-аниона. [4]
Как и следовало ожидать от систем, содержащих четыре атома азота, М - алки-лирование пуринов протекает довольно сложно, и в нем могут участвовать нейтральная молекула или N-анион. [5]
По-видимому, первоначально происходит атака аминным атомом s - триа-зинового цикла по атому углерода кратной связи второй молекулы пер-фтор-5 - азанон-4 - ена с образованием соединения, которое за счет внутримолекулярной циклизации с участием кратной связи CN и NH-фрагмента дает N-анион. [6]
В случае перфторалкилгалогенидов реакция протекает по механизму, модифицирующему версию классического SRN1 механизма, по которому перенос электрона осуществляется без промежуточного образования анион-радикала субстрата. Реакция затрагивает N-анион по гетероциклическому кольцу. [7]
 |
Ацидифицнрующие эффекты заместителей ( ЛрК по отношению к. анилину, пентафторанилину, толуолу и пентафтортолуолу ( ДМСО, 25. [8] |
Сильное возрастание ацидифицирующих эффектов ацильных групп в СН-кислотах по сравнению с NH-кислотами демонстрирует вклад сопряжения этих групп в делокализацию заряда в карбанионах. Относительное уменьшение вклада сопряжения ацильных групп в стабилизацию N-анионов может служить причиной повышения ацидифицирующего эффекта пентафторфенильной группы относительно фенильной при переходе от а-карбонилсодержащих СК-кислот к соответствующим NH-кислотам. Так, замена Ph-группы на CeF5 в дезоксибензоине приводит к понижению рК на 2 1 лог. [9]
Сульфамиды с галогеном при азоте легко отщепляют в виде катиона атом галогена и в соответствии с ионным механизмом присоединяются по месту поляризованной двойной связи. В рассматриваемом примере катион брома присоединяется к р-углероду, а более объемному N-аниону ( I) затем достается менее выгодное место при а-углероде. [10]
Сближение NH-кислот-ности пентафтор - и 4-нитродифениламинов также говорит в пользу резонансного вклада в стабилизацию N-анионов этих соединений, тогда как несколько больший ацидифицирующий. NH-кислотности пентафторанилина и 4-нитро-анилина связан со значительно большим вкладом резонансного эфф екта, стабилизирующего N-анион последнего соединения. [11]
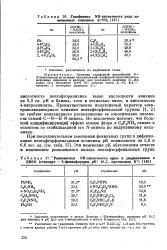 |
Газофазная NH-кислотность ряда замещенных анилинов ArNII2. [12] |
К и близка, хотя и несколько ниже, к кислотности 4-нитроанилина. Преимущественно индуктивный характер элек-троноакцепторного влияния пентафторфенильной группы [1, 2] не требует копланарного расположения ее относительно плоскости связей С-N - Н N-аниона. Не исключено поэтому, что большой ацидифицирующий эффект атомов фтора в C6F5NH2 связан в основном со стабилизацией его N-аниона по индуктивному механизму. [13]
Это можно объяснить тем, что метильная группа в re - положении вызывает повышение электронной плотности у атома азота N-аниона натриевой соли продукта присоединения, что приводит к усилению атаки азота на атом фосфора, и олефинирование протекает без нагревания. В случае о-изомера дефосфонирования в тех же условиях не происходит из-за пространственного влияния метильной группы, которое, по-видимому, проявляется в понижении нуклеофильности N-аниона. [14]
Действительно, авторы работ [43, 44] на примере восстановления CF3Br, n - C4F9I, n - C6F 3I, I ( CF2) 4I, используя посредники ( катализаторы: тетрафталонитрил ( Е - 1.60 B / SCE), нитробензол ( Е - 1.10 B / SCE), N-окись 4-нитропириди-на ( Е - 0.79 B / SCE)), показали эффективность перфторалкилирования промежуточно генерируемыми перфторалкильными радикалами N-анионов замещенных имидазола, аденина, 2 6-диоксипурина ( ксантина), оксипурина ( гипок-сантина), урацила, цитозина, барбитуровой кислоты, ламазина, теофиллина. [15]
Страницы: 1 2