N-цетил
Cтраница 1
N-цетил - З - карбамидопиридиния в слабощелочном растворе ( рН 9), когда проявляется предельное влияние на процесс разложения кумилгидроперекиси. [1]
При разложении кумилгидроперекиси в слабощелочной среде ( рН 9) в присутствии бромистого N-цетил - З - карбамидопиридиния обращает на себя внимание высокая скорость протекания процесса, а также неподчинение кинетики распада уравнениям первого порядка. Порядок реакции по гидроперекиси зависит от ее концентрации, меняясь от первого при малых значениях концентрации до нулевого при больших значениях. Порядок реакции по бромистому N-цетил - З - карбамидопиридинию первый. [2]
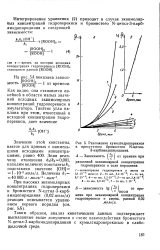 |
Разложение кумилгидроперекиси. [3] |
Таким образом, анализ кинетических данных подтверждает высказанные выше допущения о схеме взаимодействия бромистого N-цетил - З - карбамидопиридиния с кумилгидроперекисью в слабощелочной среде. [4]
На рис. 1 приведены кинетические кривые разложения кумилгидроперекиси в водных растворах бромистых N-цетилпиридиния и N-цетил - З - карбамидопиридиния в слабокислой ( рН 5), нейтральной ( рН 7) и слабоосновной ( рН 9) средах. [5]
В качестве окислительной компоненты системы избрана кумил-гидроперекись, молекулы которой способны находиться вблизи полярных групп эмульгатора; в качестве восстановительной - бромистые N-цетилпиридиний и N-цетил - З - карбамидопиридиний. N-цетил - З - карбамидопиридиний Должен обнаруживать большую активирующую способность, чем бромистый N-цетилпиридиний. [6]
В качестве окислительной компоненты системы избрана кумил-гидроперекись, молекулы которой способны находиться вблизи полярных групп эмульгатора; в качестве восстановительной - бромистые N - цетилпириДиний и N-цетил - З - карбамидопиридиний. N-цетил - З - карбамидопиридиний должен обнаруживать большую активирующую способность, чем бромистый N-це-тилпиридиний. [7]
В качестве окислительной компоненты системы избрана кумил-гидроперекись, молекулы которой способны находиться вблизи полярных групп эмульгатора; в качестве восстановительной - бромистые N - цетилпириДиний и N-цетил - З - карбамидопиридиний. N-цетил - З - карбамидопиридиний должен обнаруживать большую активирующую способность, чем бромистый N-це-тилпиридиний. [8]
В качестве окислительной компоненты системы избрана кумил-гидроперекись, молекулы которой способны находиться вблизи полярных групп эмульгатора; в качестве восстановительной - бромистые N-цетилпиридиний и N-цетил - З - карбамидопиридиний. N-цетил - З - карбамидопиридиний Должен обнаруживать большую активирующую способность, чем бромистый N-цетилпиридиний. [9]
При разложении кумилгидроперекиси в слабощелочной среде ( рН 9) в присутствии бромистого М - цетил - З - карбамидопиридиния обращает на себя внимание высокая скорость протекания процесса, а также неподчинение кинетики распада уравнениям первого порядка. Порядок реакции по гидроперекиси зависит от ее концентрации, меняясь от первого при малых значениях концентрации до нулевого при больших значениях. Порядок реакции по бромистому N-цетил - З - карбамидопиридинию первый. [10]
При разложении кумилгидроперекиси в слабощелочной среде ( рН 9) в присутствии бромистого N-цетил - З - карбамидопиридиния обращает на себя внимание высокая скорость протекания процесса, а также неподчинение кинетики распада уравнениям первого порядка. Порядок реакции по гидроперекиси зависит от ее концентрации, меняясь от первого при малых значениях концентрации до нулевого при больших значениях. Порядок реакции по бромистому N-цетил - З - карбамидопиридинию первый. [11]
На рис. 1 приведены кинетические кривые разложения кумилгидроперекиси в водных растворах бромистых N-цетилпиридиния и N-цетил - З - карбамидопиридиния в слабокислой ( рН 5), нейтральной ( рН 7) и слабоосновной ( рН 9) средах. Расчет скоростей разложения гидроперекиси по начальным участкам кинетических кривых показывает, что в случае бромистого N-цетилпиридиния в слабощелочной среде процесс протекает приблизительно в 400 раз быстрее, чем в слабокислой. В случае бромистого N-цетил - З - карбамидопиридиния скорость распада в щелочной среде примерно в 160 раз превышает скорость разложения ее в слабокислой среде. Вместе с тем распад кумилгидроперекиси в водных растворах бромистого N-цетил - З - карбамидопиридиния протекает значительно быстрее, чем в водных растворах бромистого N-цетилпиридиния. [12]
На рис. 1 приведены кинетические кривые разложения кумилгидроперекиси в водных растворах бромистых N-цетилпиридиния и N-цетил - З - карбамидопиридиния в слабокислой ( рН 5), нейтральной ( рН 7) и слабоосновной ( рН 9) средах. Расчет скоростей разложения гидроперекиси по начальным участкам кинетических кривых показывает, что в случае бромистого N-цетилпиридиния в слабощелочной среде процесс протекает приблизительно в 400 раз быстрее, чем в слабокислой. В случае бромистого N-цетил - З - карбамидопиридиния скорость распада в щелочной среде примерно в 160 раз превышает скорость разложения ее в слабокислой среде. Вместе с тем распад кумилгидроперекиси в водных растворах бромистого N-цетил - З - карбамидопиридиния протекает значительно быстрее, чем в водных растворах бромистого N-цетилпиридиния. [13]
Страницы: 1