Фенольное кольцо
Cтраница 3
Введение в фенольное кольцо хлора или метилыюй группы в о-позпцин вызывает угнетение р-окисления [30, 31, 34], которое, однако, смягчается добавлением р-хлора в фенольное кольцо. Отмечена следующая зависимость между положением заместителей и стойкостью гомологов феноксиацетата [35, 36]: 1) введение хлора в пара-позицию увеличивает лабильность молекулы; 2) введение хлора в орго-позицию замедляет разрушение; 3) введение хлора в мета-позицию также замедляет разрушение, но слабее, чем в орто-позиции; 4) замещение в пара-позиции в ди - и трихлор-феноксиалканоатах в основном угнетает влияние заместителей, введенных в других позициях; 5) введение метилыюй группы оказывает большее угнетающее действие, чем введение хлора. [31]
Нами была изучена резол ьная смола на основе фенола, ал кил и-рованного ненасыщенным соединением14, содержащая метилольные группы и метиленэфирные связи между фенольными кольцами. Процесс отверждения смолы изучался спектроскопически. При нагревании до 150 С полоса 1012 см-1 практически исчезает, уменьшается полоса валентных колебаний гидроксильной группы 3200 - 3600 слГ1, а интенсивность полосы 1050 слГ1 увеличивается. Эти изменения можно объяснить взаимодействием метилольных групп с образованием метиленэфир-ных связей; связи эти исчезают при нагревании смолы до 220 С. [32]
Группа Si-О - СбН5 менее подвержена гидролитическому расщеплению, видимо, вследствие рл - dn - и рп-рл-сопряжения электронных пар кислорода с кремнием и фенольным кольцом. [33]
Трудности, встречающиеся при применении обычных методов синтеза флавонов к получению хромоно-у-пиронов, вероятно, обусловлены тем, что бензольное ядро в флавоновой группе значительно менее реакционноспособно, чем фенольное кольцо, и поэтому замыкание второго упиронового кольца происходит значительно труднее. [34]
Для определения общего содержания гидроксиметильных [451] и мостиковых простых эфирных групп [452] в фенольных смолах применяются химические методы, которые, однако, не дают возможности установить распределение этих групп относительно фенольных колец и гидроксильной группы фенолов. Для определения ряда функциональных групп, например гидроксиметильных [453], а также средней степени замещения и положения заместителей в бензольном кольце [453-456] использовали ИКС, которая является одним из немногих методов, применимых для исследования структуры нерастворимых фенольных полимеров с поперечными связями. Однако в большинстве случаев этим методом получают только качественные результаты. Как было показано в работах [457, 458], методы бумажной хроматографии применимы только при изучении начальных стадий реакции. Они позволяют определить концентрации различных гидроксиметилированных фенолов и некоторых биядер-ных соединений. Рентгеноструктурный анализ позволяет получить информацию о геометрической структуре некоторых низкомолекулярных кристаллических компонентов, входящих в состав смол. Каждый из упомянутых методов в отдельности дает очень ограниченную информацию. Каждый конкретный метод часто оказывается неприменимым для всех типов полимеров или для продуктов разной молекулярной массы даже в случае растворимых смол. Кроме того, большинство из этих методов не являются количественными; кроме того, их точность неудовлетворительна. [35]
Литературные, а также наши экспериментальные данные показывают, что интенсивная и широкая полоса связанных ОН-групп, соответствующая полимерной межмолекулярной ассоциации, отсутствует именно в том случае, когда алкильные группы находятся в положениях 2 6 фенольного кольца. Из этих спектров видно, что во фракциях 7, 8, 9, 10, ( 14 -) - 15 16) и 17 образуется лишь слабая водородная связь в виде димеров, причем в случае фракций 8и ( 14 15 16) она почти исчезает; в последнем случае в области частоты 3600 см-1 фактически наблюдается одиночная и узкая полоса валентных колебаний свободных гидроксильных групп. В спектрах фракций 7, 9, 10 и 17, помимо узкой полосы свободных ОН-групп, наблюдается сравнительно узкая низкочастотная компонента, соответствующая ОН-группам в димеризованных молекулах. Таким образом, для алкилфенолов, десорбированных петролейным эфиром на хроматографической колонне, обнаружено наличие орто-эффекта. Из наблюдаемого орто-эффекта следует, что во фракциях 7, 8, 9, 10 ( 14 15 16) и 17 алкильные заместители находятся в диорто-положениях. [36]
Фенолфталеин [334 - 336], его гомологи, как крезолфталеин [335, 337], тимолфталеин [335], 3 - 3-быс - ( 4 -окси - 3 -нитрофенил) фталид [338], флуо-ресцеин [334 - 337, 339, 340], этил - [341], гексил - [341] и другие алкилфлуо-ресцеины [342] ( продукты - мономеркурированные соединения), 4 5-динитрофлуоресцеины [338], оксифлуоресцеины [337], производные дифе-нол - и дирезорцинизатина [343, 344] и другие оксисоединения трифенилме-танового ряда меркурируются в фенольное кольцо в спиртовом, водном, часто щелочном растворе при кипячении в течение нескольких часов. [37]
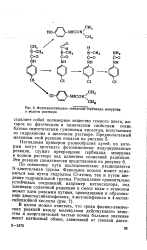 |
Фотосинтетическое окисление гербицида монурона в водном растворе. [38] |
По основному пути последовательно расщепляется N-диметильная группа. Фенольное кольцо может изменяться как путем гидролиза Cl-атома, так и путем введения гидроксильнои группы. [39]
Опыт продемонстрировал вполне удовлетворительное совпадение фактически найденного в тканях растений количества 2 4 - Д с рассчитанным по разности между количеством нанесенного на лист и смытого с поверхности листа гербицида. Уэйтрауба [6], следует предположить, что фенольное кольцо при такой экспозиции остается неизмененным. [40]
Однако точных данных пока не получено. Возможно, что алкилирование протекает после образования фенольного кольца, если оно получается через шикимовую кислоту. Можно также предполагать, как ранее упоминалось, что наиболее алкилированными фенолами [ например, ( 82), ( 83) ] являются фенолы с наибольшей нуклеофильной активностью. [41]
Ингибирующая способность противостарителей зависит от их структуры. Заместители ОСН3, ОН, С1 в пара-положении в фенольном кольце значительно увеличивают ингибирую-щую способность вторичных аминов. [42]
Пнпгоирующая способность противостарителей зависит от их структуры. Заместители ОСН3, ОН, С1 в пара-положении в фенольном кольце значительно увеличивают ингибнрую-щую способность вторичных аминов. [43]
Анализ инфракрасных спектров всех исследованных индивидуальных алкилфенолов показал, что в области частот 1495 - 1500 см-1 в определенных случаях отсутствует характеристическая полоса ароматических структур. Эта полоса отсутствует в том случае, когда в диорто-положениях фенольного кольца присутствуют алкильные заместители. Следовательно, в указанных фракциях заместители присутствуют в диорто-положениях. [44]
Мужские и женские половые гормоны имеют стероидное строение. Женские половые гормоны ( фолликулин, эстра-диол и эстриол) содержат фенольное кольцо и поэтому дают ряд реакций, характерных для фенолов. [45]
Страницы: 1 2 3 4