Концентрация - ион - калий
Cтраница 1
Концентрация ионов калия, натрия, кальция имеет регулирующее значение в направленной проницаемости сумки и хрусталиковых волокон, которая с возрастом снижается. [1]
Такая концентрация ионов калия в водном растворе является нереальной. [2]
У соответствует концентрации ионов калия. [3]
К ] - концентрация иона калия; &i [ NH - ] - скорость реакции 2; k2 [ NH [ K ] - скорость той же реакции, катализируемая ионами калия. [4]
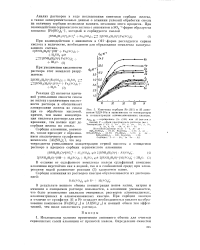 |
Киношка сорбции Fe ( HI и Al auiio - нитом ЭДЭ-1 ( п в зависимости от температуры и концентрации алюмоаммониевых квасцов. [5] |
В результате ионного обмена концентрация ионов калия, натрия и аммония в очищаемом растворе повышается, а алюминия уменьшается, что было установлено анализом очищенных растворов алюмокалиевых, алюмонатриевых и алюмоаммониевых квасцов. При сорбции квасцов в отличие от сульфатов А1 и Fe отпадает необходимость в кислоте на образование комплексов [ Fe ( S04) 2 ] и [ A1 ( SO4) 2 ] и ионный обмен тем эффективней, чем ниже кислотность раствора. [6]
В биологических системах внутри клетки концентрация ионов калия обычно высока, а вне ее высока концентрация ионов натрия. По обе стороны от клеточной мембраны, разделяющей внешнюю и внутреннюю области, присутствует некоторое количество анионов, главными из которых являются ионы хлора. Именно эти три иона ( К, Na и СГ) управляют электрической активностью большинства живых клеток. Поскольку общие концентрации растворов - внешнего и внутреннего - равны, уравнение ( II 1.96) для трех основных ионов, создающих электрический потенциал мембраны, остается в силе. [7]
Калий-селективный электрод позволяет непосредственно определять концентрацию ионов калия. Анализируемые растворы не должны содержать органических соединений, загрязняющих или растворяющих активную фазу. При высоких концентрациях ряд катионов оказывает мешающее влияние. После исследования растворов с высоким содержанием мешающих ионов время отклика электрода увеличивается и наблюдается дрейф потенциала. [8]
Данные рис. III.5 показывают, что о увеличением концентрации ионов калия ( и других щелочных металлов [114]) равновесный потенциал системы Fe ( CN) iJ - смещается в сторону более положительных значений. Такая же, но менее резко выраженная зависимость сохраняется и в случае соли ( СНз НВя при ее небольших концентрациях ( см. рио. [9]
В результате взаимодействия этих сил создается диффузное распределение противоионов - концентрация ионов калия постепенно убывает по мере удаления от поверхности. [10]
В дополнение к обычно замеряемым параметрам бурового раствора добавляется ежедневный контроль концентрации ионов калия и полимера. На глубинах, где температура превышает 121 С, концентрация полимера должна быть выше 1 4 кг / м3 вследствие медленной термической дегидратации полимера. [11]
С увеличением плотности тока относительный перенос ионов Н возрастает, так как концентрация ионов калия продолжает уменьшаться, а концентрация ионов Н поддерживается постоянной благодаря разложению воды. [12]
Из рассмотрения уравнений ( 1) и ( 2) становится очевидно, что при равновесии концентрации ионов калия и хлора в фазе мембраны сильно отличаются друг от друга, если концентрация фиксированного иона в мембране велика, например в случае мембран, изготовленных из синтетических ионитов. Поскольку числа переноса ионов в системе зависят как от их относительных концентраций, так и от их подвижностей, в фазе мембраны число переноса более концентрированного иона ( иона калия в приведенном выше случае) будет значительно превышать эту же величину в растворе электролита. Если [ А - ] велика, [ С1 - ] будет относительно небольшой и число переноса иона хлора будет почти равно нулю. Следовательно, эта мембрана является в сильной степени селективно проницаемой для катионов, в нашем случае - для иона - калия. Этот эффект увеличивает число переноса ионов хлора и снижает селективную проницаемость по отношению к катионам. При снижении концентрации электролита селективная проницаемость приближается к теоретическому максимуму для идеальной мембраны. Однако в каждом электролитическом процессе концентрации ионов имеют вполне ощутимые величины, и поэтому полная селективная проницаемость является идеализированной ситуацией, представляющей небольшой интерес для практики. К ней можно приблизиться при умеренных концентрациях электролитов, если применять мембраны с высокой обменной емкостью или, что то же, с высокой концентрацией фиксированного иона. [13]
Последняя константа согласуется со значением К 36 2 М, полученным при тех же условиях из зависимости скорости реакции акватации гексахлоридных комплексов Ir ( III) от концентрации ионов калия ( см. разд. [14]
Концентрационные изменения этих показателей имеют разные знаки и равны: Д / г / Дж - 0 9 10 - 4 и Дтг3 / Дз; 2 0 10 - 4, где х - концентрация ионов калия в кристалле в мольных долях. [15]
Страницы: 1 2 3 4