Концентрация - раствор - соль
Cтраница 2
Приборы, измеряющие концентрацию растворов солей, применяют во многих отраслях промышленности, в частности для контроля качества воды и пара в паровых коглах. [16]
Последний в зависимости от концентрации раствора соли Pb имеет разную форму: из приблизительно 0 1 % - ного раствора Pb ( NO3) 2 выпадают дендриты и ромбы ( рис. 69), из более слабых растворов оседают преимущественно шестиугольники и Х - образные кристаллы. [17]
Для доказательства этой формулы обозначим концентрацию раствора соли, который содержится в сосуде после п переливаний, через сп. [18]
После заполнения бака-мерника следует проверить концентрацию раствора соли в нем, данные записать в оперативный журнал. На этом операция приготовления концентрированного раствора соли закончена. [19]
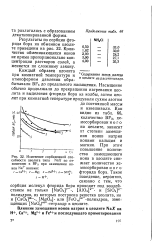 |
Изменение сорбционной способности цеолита типа NaX по отношению к ВРз при замещении ионов Na. ионами. / Са2. 2 - Mg. 3 - Fe3. 4 - NH. [20] |
Количество обменивающихся ионов не прямо пропорционально концентрации растворов солей, а меняется по сложному закону. [21]
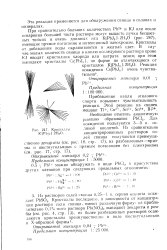 |
Кристаллы К [ РЬ ] ] - 2Н2О. [22] |
Кристаллы последнего, в зависимости от концентрации раствора соли свинца, имеют различную форму: из приблизительно 0 1 % - ного раствора Pb ( NO3) 2 выпадают дендриты и ромбы ( см. рис. 4, стр. [23]
К - поправочный коэффициент для приведения концентрации раствора соли железа ( II) к точно 0 1 н; V-объем анализируемой. [24]
На величину степени гидролиза влияет температура и концентрация раствора соли. Чем выше температура и чем больше разбавлен раствор водой, тем больше степень гидролиза. Это объясняется тем, что с увеличением температуры резко возрастает концентрация Н - и ОН - - ионов из воды. Увеличение же концентрации воды, как видно из уравнений гидролиза, смещает равновесие гидролиза вправо. Однако на опыте найдено, что степень гидролиза солей, образованных слабой кислотой и слабым основанием, от разбавления не зависит. [25]
На величину степени гидролиза влияет температура и концентрация раствора соли. Чем выше ] температура и чем больше разбавлен раствор водой, тем больше степень гидролиза. Это объясняется тем, что с увеличением температуры резко возрастает концентрация Н - и ОН - - ионов воды. Увеличение же концентрации воды, как видно из уравнений гидролиза, смещает равновесие гидролиза вправо. Однако на опыте найдено, что степень гидролиза солей, образованных слабой кислотой и слабым основанием, от разбавления не зависит. [26]
Кондуктометрическое титрование применяют таю же для определения концентрации растворов солей. [27]
Качество образующегося катализатора зависит от условий осаждения - концентрации растворов солей, температуры и скорости осаждения. В каждом отдельном случае эти условия приходится подбирать. [28]
Хотя в первом примере ( табл. 2) концентрация раствора соли кальция уменьшается в 16 раз, однако быстрота появления кристаллов уменьшается только в 5 раз; в примере с раствором нитрата при понижении концентрации в 4 раза быстрота появления кристаллов уменьшается только приблизительно в 2 раза. [29]
Обычно значения Е определяются при температуре 25 и при одномолярных концентрациях растворов солей. [30]
Страницы: 1 2 3 4