Атом - ксенон
Cтраница 2
В молекуле XeF4 атомы ксенона не соприкасаются друг с другом. [16]
Какую скорость могут приобрести атомы ксенона при истечении в вакуум смеси водорода и малого количества ксенона, находящихся при комнатной температуре. [17]
Какую скорость могут приобрести атомы ксенона при истечении в вакуум смеси водорода и малого количества ксенона при комнатной температуре. [18]
В любом случае именно атомы ксенона определяют рассеяние рентгеновских лучей, и знаки структурных факторов F ( hkl) с несмешанными индексами h, k, I ( все - четные или все нечетные) определяются только положениями ксенона. [19]
Волновые функции ССП для атома ксенона неизвестны. Этот же пересчетный фактор применен для перехода от 5 / 7-орбиты иона цезия [24] к 5р - орбите ксенона. [20]
В соединении инертного газа XeF4 атом ксенона окружают двенадцать валентных электронов, поэтому его структура должна быть аналогична структуре SFe - И в этом случае возможны две структуры молекулы. В структуре, изображенной на рис. 6.8, а, связи расположены в одной плоскости, в квадратной конфигурации; при этом-в молекуле осуществляется восемь отталкиваний яп - сп, но зато совсем нет отталкиваний нп - нп. В структуре на рис. 6.8, б ( она напоминает структуру SF4) имеется одно взаимодействие нп - нпг но зато всего только шесть отталкиваний нп - сп. Для объяснения наблюдаемой экспериментально геометрии плоского квадрата ( рис. 6.8, в) приходится постулировать, что отталкивания нп - нп превышают отталкивания нп - сп [ как мы правильно угадали в ( 6 - 9) ] в значительно большей степени, чем отталкивания нп - сп превышают отталкивания сп - сп. [21]
 |
Трехцентровые связывающие орбитали в молекулах XeF2 ( a, XeF4 ( б и ХеР ( в. [22] |
Поскольку каждая 5р - орбиталь атома ксенона способна к образованию линейного фрагмента F - Хе - F, аналогичным образом можно объяснить строение квадратной молекулы XeF4 и октаэдрической молекулы XeFe. [23]
В основном же, состоянии атома ксенона все спины электронов внешней оболочки ( 5s25p6) будут скомпенсированы и ксенон не сможет вступать в химические реакции. Подчеркнем также, что строгое разделение химических связей на гомеополярные и гете-рополярные, вообще говоря, невозможно. Оба типа связи соответствуют крайним случаям распределения электронной плотности в незаполненных оболочках. Случай крайней асимметрии в распределении электронной плотности между атомами соответствует гетерополярной молекуле. [24]
Пространственная группа P2i / n; атомы ксенона располагаются в положениях ( 0, 0, 0), ( / 2, / 2, llz), атомы фтора - в общих положениях. Тип симметрии указывает на то, что молекула имеет плоскостное расположение. [25]
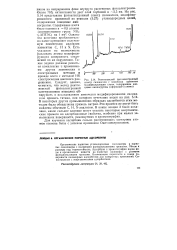 |
Рентгеновский фотоэлектронный спектр силикагеля с химически прибитым модифицирующим слоем, содержащим концевые аминогруппы ( сферисорб-5 - амино. [26] |
Для изучения адсорбции сильно рассеивающих электроны атомов ксенона была с успехом применена Оже-спектроскопия. [27]
Молекула ХеО4 имеет структуру тетраэдра с атомом ксенона в центре, а связь ХеО характеризуется ядерным расстоянием i ( XeO) 1 74 А и энергией 21 ккал / моль. Давление пара этого окисла составляет 3 мм рт. ст. при - 35 С. [28]
Энергии связи электронов на К - и L-оболочках атома ксенона равны соответственно 34 8 и 5 4 кэв. Определить длину волны монохроматического рентгеновского излучения, при которой кинетическая энергия фотоэлектрона, освобождаемого с / ( - оболочки, равна кинетической энергии электрона, освобождаемого в результате эффекта Оже с L-оболочки. [29]
В каком объеме воздуха при нормальных условиях содержится 1010 атомов ксенона. [30]
Страницы: 1 2 3 4