Электроотрицательный атом - хлор
Cтраница 2
ОН электроотрицательным атомом хлора, означает вместе с тем и роста в этом ряду. [16]
В молекуле этилена плотность я-электронов распределяется симметрично. Введение же в эту молекулу электроотрицательного атома хлора вместо атома водорода нарушает электронную симметрию. [17]
В молекуле этилена плотность тс-электронов распределяется симметрично. Введение же в эту молекулу электроотрицательного атома хлора вместо атома водорода нарушает электронную симметрию. [18]
Уменьшение скорости гидролиза в 8 и 4 раза соответственно при переходе от метил - и этилхлорацетата [2, 9] к изопропилхлорацетату объясняется, вероятно, пространственным затруднением реакции для изонропилового эфира. Такое увеличение скорости щелочного гидролиза эфиров монохлоруксус-ной кислоты объясняется сильным индукционным ( - /) эффектом электроотрицательного атома хлора на карбонильный атом углерода, в результате чего, в соответствии с общепринятым механизмом реакции гидролиза [10], облегчается атака нуклеофильного агента ( ОН) на реакционный центе. [19]
Уменьшение скорости гидролиза в 8 и 4 раза соответственно при переходе от метил - и этилхлорацетата [2, 9] к изопропилхлорацетату объясняется, вероятно, пространственным затруднением реакции для изопропилового эфира. Такое увеличение скорости щелочного гидролиза эфиров монохлоруксус-нон кислоты объясняется сильным индукционным ( - /) эффектом электроотрицательного атома хлора на карбонильный атом углерода, в результате чего, в соответствии с общепринятым механизмом реакции гидролиза [10], облегчается атака нуклеофильного агента ( ОН) на реакционный цеито. [20]
Величина К зависит от характера химической связи в молекуле диссоциирующего соединения. Так, увеличение К в ряду кислот СНзСООН - СН2С1СООН - СНС12СООН - СС13СООН обусловлено оттягиванием электронов от группы ОН электроотрицательным атомом хлора. [21]
Величина К зависит от характера химической связи в молекуле диссоциирующего соединения. Так, увеличение К в ряду кислот СНзСООН - СН2С1СООН - СНС12СООН - CCbCQOH обусловлено оттягиванием электронов от грувпы ОН электроотрицательным атомом хлора. [22]
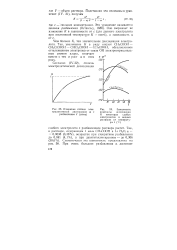 |
Изменение степени электролитической диссоциации с разбавлением V ( схема.| Зависимость константы диссоциации К некоторых слабых электролитов в водных растворах от температуры t ( с. [23] |
Так, увеличение / С в ряду кислот СНзСООН - СН2С1СООН - СНС12СООН - ССЬСООН, обусловленное отталкиванием электронов от связи ОН электроотрицательным атомом хлора, означает вместе с тем и рост а в этом ряду. [24]
Сейчас считается общепринятым, что хлористый винил стабилизуется в результате сопряжения ( обратная координация), поскольку связь С - С1 частично имеет характер двойной связи, а следовательно, и его теплота гидрирования должна быть меньше теплоты гидрирования этилена. То обстоятельство, что в действительности теплота гидрирования хлористого винила больше теплоты гидрирования этилена, указывает на стабилизацию продукта гидрирования, хлористого этила, обусловленную ионно-ковалентным резонансом за счет сильно электроотрицательного атома хлора. [25]
Подобные соединения, например С1 - СН СН - HgCl или НО-СН - СН2 - HgCl, обладают аналогичным строением в том смысле, что цепь из двух углеродных атомов соединена, с одной стороны, с электроположительным металлом, а с другой - с электроотрицательным атомом хлора или кислорода. [26]
Свободный иминотиоэфир не является первой ступенью реакции образования эфира тиокислоты. Доказательством служит тот факт, что свободный иминоэфир, выделенный раствором поташа, устойчив к действию воды. В данном случае № 3 влияние трех электроотрицательных атомов хлора проявляется так же, как при образовании обычного трихлорацетиминометилового эфира из метилового спирта и трихлор-ацетонитрила. [27]
Если в молекуле воды или аммиака один из атомов водорода замещают более электроотрицательным атомом ( группой атомов), то увеличивается эффективная электроотрицательность атома кислорода или азота, и он сильнее притягивает электронную пару. В результате усиливается кислотный характер соответствующего соединения. Поэтому, например, хлорноватистая кислота НОС 1 или азотная кислота HONO2, которые можно рассматривать как произвол ные воды, в которой один атом водорода заменен электроотрицательным атомом хлора или электроотрицательной группой N02, являются более сильными кислотами, чем Н20; основные же свойства этих соединений значительно слабее. [28]
В отличие от полимеризации при каталитической олигомери-зации реакция гидридного перехода является нужной. При этом желательно сохранение всех тех же соотношений скоростей остальных индивидуальных реакций, что и при полимеризации. С первой системой был получен твердый полиэтилен, тогда как использование второй приводит к образованию жидкого оли-гоэтилена, содержащего главным образом 2-этил - 1-олефины. Столь большое различие обусловлено заменой электроположительных циклопентадиенильных лигандов на электроотрицательные атомы хлора. [29]
Если анализируемые соединения значительно отличаются от растворителя по гидрофильным свойствам или полярности, то нельзя ожидать хороших результатов. Растворители обычно классифицируют по элютроп-ным или миксотропным рядам. Наличие я-злектронов двойной связи в растворителе приводит к увеличению его полярности и элюирующей способности и к уменьшению элюируемости вещества на полярных сорбентах или на полярных неподвижных фазах. Так, например, бензол - значительно лучший элюент, чем циклогексан. Распространенный заместитель, не слишком увеличивающий гидрофильность - это хлор ( хотя он может значительно увеличить дипольный момент вещества); другие галогены едва ли имеет смысл рассматривать в этой связи. Например, тетрахлор-метан неполярен, хотя содержит сильно электроотрицательные атомы хлора; его молекула симметрична и поэтому не имеет ди-польного момента. В то же время хлороформ значительно более полярен благодаря низкой степени симметрии его молекулы и значительному дипольному моменту, а его элюирующая способность значительно выше, чем у тетрахлорметана. Соединения с нитрогруппой рассматриваются редко, хотя наличие этой группы значительно усиливает полярный и гидрофильный характер вещества; подобным образом действует и тиольная группа. Аминные и карбоксильные группы очень высокополярны даже в неионизованном виде, а в ионизованном состоянии соответствующие соединения становятся крайне гидрофильными. Важную роль играет соотношение между длиной алифатической цепи и числом заместителей. Например, две или три простые эфирные группы в молекуле оказывают такое же влияние на гидрофильный характер вещества, как и гидроксильная группа. [30]
Страницы: 1 2